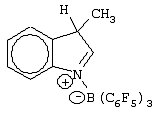
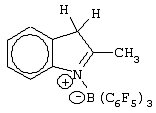
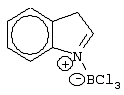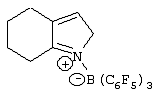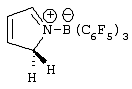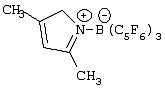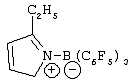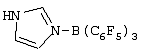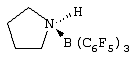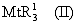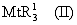Патент на изобретение №2248980
|
||||||||||||||||||||||||||
(54) МЕТАЛЛООРГАНИЧЕСКОЕ СОЕДИНЕНИЕ, ПРИГОДНОЕ В КАЧЕСТВЕ СОКАТАЛИЗАТОРА ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ
(57) Реферат:
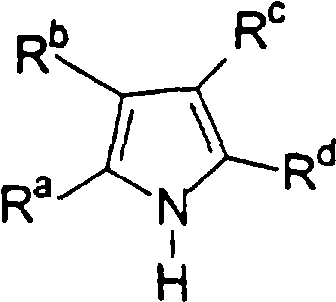
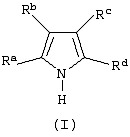
Изобретение относится к новым металлоорганическим соединениям и к каталитическим системам для полимеризации олефинов, включающих такие металлоорганические соединения. Изобретение также относится к способу полимеризации олефинов, проводимому в присутствии данной каталитической системы. Новое металлоорганическое соединение получают приведением в контакт а) соединения формулы (I) где Rа, Rb, Rc и Rd, одинаковые или отличающиеся друг от друга, являются углеводородными группами; с b) льюисовской кислотой формулы MtR13, где Mt представляет собой атом бора; R1, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из галогена и галогенированных С6-С20-арильных групп. Технический результат изобретения заключается в получении нового класса сокатализаторов полимеризации олефинов, которые уменьшают использование избытка сокатализатора по сравнению с алкилалюмоксанами, не приводят к получению нежелательных побочных продуктов после активации металлоцена и обеспечивают стабильные каталитические композиции. 4 н. и 10 з.п. ф-лы, 1 табл.
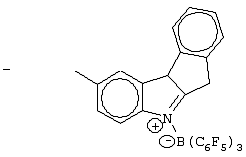
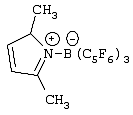
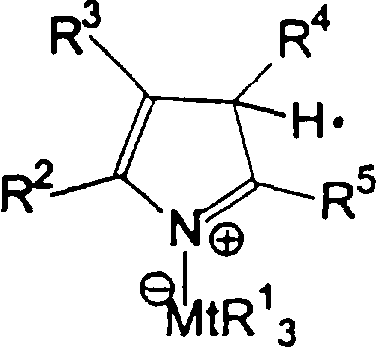
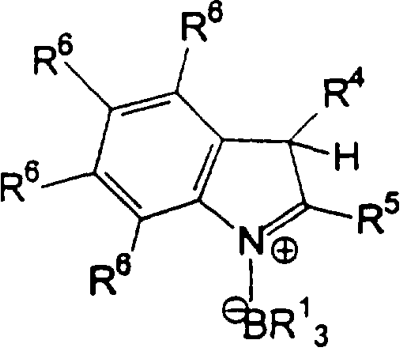
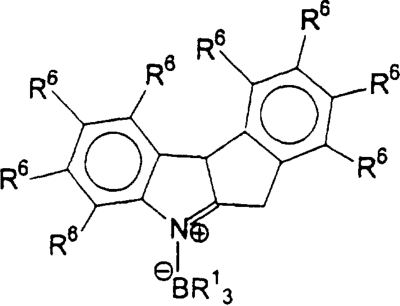
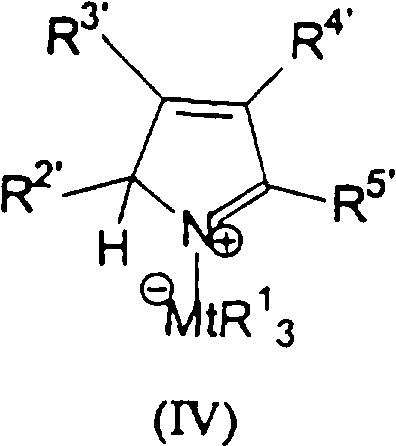
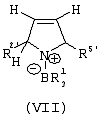
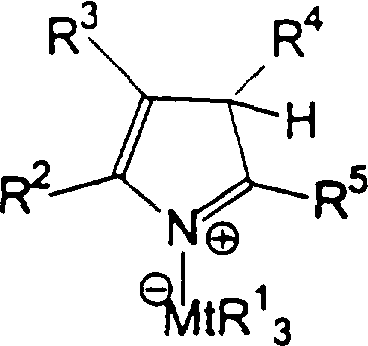
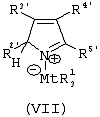
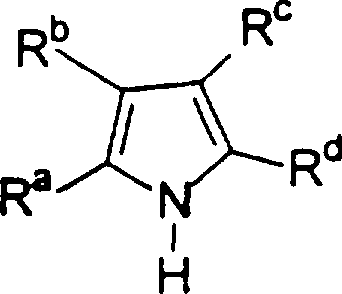
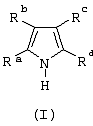
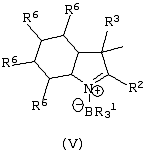
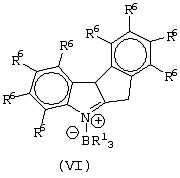
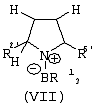
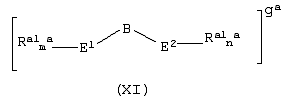
Область изобретения Настоящее изобретение относится к металлоорганическим соединениям и к каталитическим системам для полимеризации олефинов, включающих такие металлоорганические соединения. Изобретение также относится к способу полимеризации олефинов, проводимому в присутствии описанной выше каталитической системы. Описание предшествующего уровня техники Гомогенные каталитические системы на основе металлоценовых комплексов известны как активные в полимеризации олефинов; указанные комплексы могут быть активированы посредством подходящих соединений, являющихся катализаторами. Первое поколение катализаторов, разработанных для гомогенной полимеризации олефинов металлоценами, состояло из хлоридов алкилалюминия (AlR5Сl), в которых заместители R предпочтительно являются метилом или этилом; эти сокатализаторы характеризуются низким уровнем активности при полимеризации этилена и пренебрежимо малой активностью при полимеризации пропилена. Второе поколение совместных каталитических систем включало класс алкилалюмоксанов, обычно получаемых реакцией триалкил-алюминиевого соединения и воды в мольном отношении от 1:1 до 100:1; эти алюмоксаны являются олигомерными линейными и/или циклическими соединениями, представляемыми формулой: в случае линейных олигомерных алюмоксанов и в случае циклических олигомерных алюмоксанов, в которых заместители R обычно являются метильной, этильной или изобутильной группами, n изменяется в диапазоне от 4 до 40, и m изменяется от 3 до 40. Метилалюмоксан (МАО) является наиболее активно используемым сокатализатором. Несмотря на это, алкилалюмоксаны и, в особенности, метилалюмоксан (МАО), хотя они очень активны в каталитических системах на основе металлоценов, обладают рядом присущих им внутренних проблем при использовании, таких как необходимость высоких мольных отношений алюмоксан/металлоцен для получения удовлетворительной каталитической активности, их высокая реакционная активность по отношению к примесям (влага, спирты и т.д.) и легкая воспламеняемость. Более того, при использовании МАО, не удалось изолировать характеризуемые металлоценовые активные образцы. Таким образом, некоторые из направлений исследований в этой области включают поиск альтернативных сокатализаторов. В качестве сокатализаторов для систем на основе металлоценов были разработаны некоординационные анионы типа В(С6F5)–4. Конкретнее, эти активаторы представляют собой ионообменные соединения, содержащие триалкил- или диалкиламмониевый катион, который необратимо реагирует с металлоценом, и фторированный арилборатный анион, способный стабилизировать металлоценовый катионный комплекс и достаточно лабильный, чтобы делать возможным замещение этиленом во время полимеризации (см., например, WO 91/02012). В особенности их преимущество состоит в том, что их используют в отношении катализатор-сокатализатор 1:1. Поэтому в отличие от указанных выше сокатализаторов на основе алюминия обычно нет необходимости удалять небольшое количество бора из конечного полимера. Предпочтительными активаторами являются три(н-бутил)аммоний, тетракис(пентафтор-фенил)бор и N,N-диметиланилиний тетракис(пентафторфенил)бор. Эти сокатализаторы обладают высокой каталитической активностью, но с синтетической точки зрения промышленное производство этих сокатализаторов крайне дорогостоящее. Наконец, эти анионы B(B6F5)–4 обычно используются в форме соответствующих аммониевых солей, приводя таким образом к получению аминового побочного продукта вследствие активации металлоценом. Кроме того, они характеризуются низкой растворимостью в полимеризационных растворителях. Четвертым поколением сокатализаторов является В(С6F5)3. Анион МеВ(С6F5)–3, получаемый после выделения Me– из металлоценового диметильного комплекса, слабо координирован с электронодефицитным металлическим центром, таким образом приводя к уменьшению каталитической активности, и к тому же каталитическая система является нестабильной. Альтернативный путь использования В(С6F5)3 был предложен В. Temme в Journal of Organometallic Chemistry 488 (1995) 177-182. Бис-циклопентадиенилметилпирролидилцирконоцен обрабатывали В(С6F5)3 с образованием пирролидилбората и металлоценового катиона. В этой статье сообщается, что полученная соль является каталитически активной и полимеризует этилен, хотя и с умеренной активностью. В WO 99/64476 раскрывается способ получения полиолефинов при использовании каталитической системы, включающей металлоценовое соединение, льюисовский кислотно-основный комплекс и три-н-алкилалюминиевое соединение. Как описано на странице 4 и проиллюстрировано на фигурах, назначением льюисовского основания является ингибирование реакции между металлоценовыми соединениями и льюисовской кислотой. Только при добавлении три-н-алкилалюминиевого соединения каталитическая система становится активной. Эта каталитическая система не полностью решает проблемы использования В(С6F5)3 с той точки зрения, что анион, слабо координированный с электронодефицитным металлическим центром, всегда представляет собой МеВ(С6F5)–3, и поэтому активная каталитическая система нестабильна в течение длительного времени. Поэтому до сих пор сохраняется необходимость в альтернативных легко получаемых сокатализаторах, которые образуют стабильную каталитическую систему и способны показывать хорошую активность в полимеризации олефинов. Заявители обнаружили в настоящее время новый класс сокатализаторов полимеризации олефинов, которые уменьшают использование избытка сокатализатора по сравнению с алкилалюмоксанами, не приводят к получению нежелательных побочных продуктов после активации металлоцена и обеспечивают стабильные каталитические композиции. Настоящее изобретение относится к металлоорганическому соединению, получаемому введением в контакт а) соединения, имеющего следующую формулу (I) где Ra, Rb, Rc и Rd, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, галогена, линейных или разветвленных, насыщенных или ненасыщенных C1-С10 алкильных, C6-C20 арильных, C7-C20 арилалкильных и С7-С20 алкиларильных групп, необязательно содержащих атомы О, S, N, P, Si или галогена, или два или более соседних заместителя Ra, Rb, Rc и Rd образуют одно или несколько С4-С7 колец, необязательно содержащих атомы О, S, N, Р или Si, которые могут нести заместители; с б) льюисовской кислотой формулы (II) где Mt представляет собой металл, относящийся к 13 группе Периодической таблицы элементов (ИЮПАК); R1, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из галогена, галогенированных С6-С20-арильных и галогенированных С7-C20 алкиларильных групп; две группы R1 могут также образовывать с металлом единое конденсированное кольцо, такое как, например, 9-борфлуореновые соединения. Предпочтительно, Mt представляет собой В или Аl и более предпочтительно представляет собой В. Заместители R1 предпочтительно выбирают из группы, состоящей из C6F5, C6F4H, C6F3H2, С6Н3(СF3)2, перфторбифенила, гептафторнафтила, гексафторнафтила и пентафторнафтила. Наиболее предпочтительно заместителями R1 являются радикалы С6F5. Предпочтительные металлоорганические соединения являются теми, которые относятся к следующим двум классам (1) и (2), имеющим соответственно формулу (III) и (IV) Класс (1) Металлоорганические соединения, относящиеся к классу (1), имеют следующую формулу (III) где Mt представляет собой металл, относящийся к 13 группе Периодической таблицы элементов (ИЮПАК); R1, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из галогена, галогенированных С6-С20-арильных и галогенированных С7-C20 алкиларильных групп; две группы R1 могут также образовывать с металлом Mt одно конденсированное кольцо, такое как, например, 9-борфлуореновые соединения; и заместители R5, R4, R3 и R2, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, галогена, линейных или разветвленных, насыщенных или ненасыщенных C1-С10 алкильных, C6-C20 арильных, С7-С20 арилалкильных и С7-С20 алкиларильных групп, необязательно содержащих атомы О, S, N, P, Si или галогена, или два или более соседних заместителей R2-R5 образуют одно или несколько С4-С5 колец, необязательно содержащих О, S, N, Р или Si атомы, предпочтительно, если заместители R2-R5 образуют одно или несколько колец, R4 и R5 образуют одно C4-C7 ароматическое кольцо, необязательно содержащее атомы О, S, N или Р, которые могут нести заместители; и R2 и R3 образуют одно неароматическое C4-C7 кольцо, необязательно содержащее атомы О, S, N, Р или Si; при условии, что, по крайней мере, один из R2, R3, R4 и R5 является отличным от водорода. Предпочтительно в металлоорганических соединениях формулы (III) Mt является В или Al и более предпочтительно является В; заместители R1, одинаковые или отличающиеся друг от друга, предпочтительно выбирают из группы, состоящей из C6F5, C6F4H, С6F3Н2, С6Н3(СF3)2, перфторбифенила, гептафторнафтила, гексафторнафтила и пентафторнафтила; и еще более предпочтительно R1 является С6F5; по крайней мере один из заместителей R5 и R4 предпочтительно является С6-С20 арильной, C7-C20 арилалкильной и С7-С20 алкиларильной группой, необязательно содержащими атомы О, S, N или Р, которые могут нести заместители. Предпочтительным подклассом металлоорганических соединений формулы (III) являются соединения формулы (V): где В является атомом бора; заместители R1, R3 и R2 имеют значения, представленные выше, и заместители R6, одинаковые или отличающиеся друг от друга, выбирают из группы, включающей водород, галоген, линейные или разветвленные, насыщенные или ненасыщенные C1-С10-алкильные, С6-С20-арильные, С7-С20-арилалкильные и C7-C20 алкиларильные группы, необязательно содержащие атомы О, S, N, Р, Si или галогенов, или два или более соседних заместителей R6 образуют одно или несколько C4-C7 колец, необязательно содержащих атомы О, S, N, Р или Si, которые могут нести заместители; предпочтительно R выбирают из группы, состоящей из водорода, галогена, линейного или разветвленного, насыщенного или ненасыщенного C1-С10 алкила. Предпочтительно R2 и R3 являются водородом. Другим предпочтительным подклассом металлоорганических соединений формулы (III) являются соединения формулы (VI): где заместители R1 и R6 имеют описанные выше значения. Класс (2) Металлоорганическое соединение, относящееся к классу (2), имеет следующую формулу (IV): где Mt и R1 определены, как указано выше. Заместители R2′, R3′, R4′ и R5′, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, галогена, линейных или разветвленных, насыщенных или ненасыщенных C1-С10-алкильных, С6-С20-арильных, С7-С20-арилалкильных и С7-С20-алкиларильных групп, необязательно содержащих атомы О, S, N, Р, Si или галогенов, или два или более соседних заместителей R2’, R3’, R4’ и R5’ образуют одно или несколько C4-C7 колец, необязательно содержащих атомы О, S, N, Р или Si, которые могут нести заместители; указанные кольца могут быть алифатическими или необязательно могут содержать двойные связи, при условии, что указанные кольца не являются ароматическими. Предпочтительные заместители R2’, R3’, R4’ и R5’, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, линейных или разветвленных, насыщенных или ненасыщенных C1-С10-алкилов, необязательно содержащих атомы О, S, N, Р, Si или галогенов, или два или более соседних заместителей R2’, R3’, R4’ и R3’ образуют одно или несколько С4-С7 колец, необязательно содержащих атомы О, S, N, Р или Si, которые могут нести заместители; указанные кольца могут быть алифатическими или необязательно могут содержать двойные связи, при условии, что указанные кольца не являются ароматическими. Предпочтительным подклассом металлоорганических соединений формулы (IV) являются соединения формулы (VII): где заместители R1 имеют то же значение, что и описано выше, а заместители R2’ и R5’, одинаковые или отличающиеся друг от друга, являются C1-C20 алкилом; предпочтительно они являются метильной или этильной группами. Неограничивающими примерами соединений, относящихся к формуле (I), являются: пиррол, этил 3,5-диметил-2-пирролкарбоксилат; трет-бутил-3,4,5-триметил-2-пиррол карбоксилат; этил 3,4-диэтил-5-метил-2-пиррол карбоксилат; третбутил 4-ацетил-З,5-диметил-2-пиррол карбоксилат; диэтил 3,4-пирролдикарбоксилат; 2-этилпиррол; 2,4-диметилпиррол; 2,5-диметилпиррол; 4,5,6,7-тетрагидроиндол; 1,2,5-триметилпиррол; 2,4-диметил-3-этилпиррол; 3-ацетил-2,4-диметилпиррол; 3-этил-2-метил-1,5,6,7-тетрагидро-4-Н-индол-4-он; 2-ацетилпиррол; 2-(трихлорацетил)пиррол; 1,5,6,7-тетрагидро-4h-индол-4-он; 2-(трифторацетил)пиррол; пиррол-2-карбоксальдегид; индол; 2-метилиндол; 3-метилиндол; 4-метилиндол; 5-метилиндол; 6-метилиндол; 7-метилиндол; 2,3-диметилиндол; 2,5-диметилиндол; 5-фториндол; 4-хлориндол; 5-хлориндол; 6-хлориндол; 5-хлор-2-метилиндол; 5-броминдол; 5-метоксииндол; 4-метоксииндол; 5-ацетокси-2-метилиндол; 5,6-диметоксииндол; 5-бензилоксииндол; 4-нитроиндол; 5-нитроиндол; 3-ацетилиндол; 3-(трифторацетил)индол; индол-3-карбоксиальдегид; 2-метилиндол-3-карбоксиальдегид; 5-метоксииндол-3-карбоксиальдегид; фенил-3,3’-диметил-2,2’-дииндолметан; 3-индолил ацетат; 4-индолил ацетат; метил индол-4-карбоксилат; метил 4-метокси-2-индолкарбоксилат; 3-цианоиндол; 5-цианоиндол; 7-азаиндол. Примерами льюисовской кислоты формулы (II) являются: трис(пентафторфенил)боран; трис(гептафторнафтил)боран; трис(2,3,5,6,7,8-гексафторнафтил)боран; трис(2,4,5,6,7,8-гексафторнафтил)боран; трис(3,4,5,6,7,8-гексафторнафтил)боран; трис(2,3,4,6,7,8-гексафторнафтил)боран; трис(2,3,4,5,7,8-гексафторнафтил)боран; трис(2,3,5,6,7,8-гексафтор-4-метилнафтил)боран; трис(2,4,5,6,7,8-гексафтор-3-метил-нафтил)боран; трис(3,4,5,6,7,8-гексафтор-2-метилнафтил)боран; трис(2,3,4,6,7,8-гексафтор-5-метилнафтил)боран; трис(2,3,4,5,7,8-гексафтор-6-метилнафтил)боран; трис(нонафторбифенил)боран; трис(2,2’,3,3’,5,5’,6,6’-октафторбифенил)боран; трис(3,3’,4,4’,5,5’,6,6’-октафторбифенил)боран; трис(2,2’,4,4’,5,5’,6,6’-октафторбифенил)боран; трис(2,2’,3,3’,4,4’,6,6’-октафторбифенил)боран; трис(2,2’,3,3’,4,4’,5,5’-октафторбифенил)боран; трис(2,2’,3,3’,5,5’,6,6’-октафторбифенил)боран; трис(3,3’,4,4’,5,5’,6,6’-октафторбифенил)боран; трис(2,2’,4,4’,5,5’,6,6’-октафторбифенил)боран; трис(2,2’,3,3’,4,4’,6,6’-октафтор-5,5′-метилбифенил)боран; трис(2,2’,3,3’,4,4’,5,5’-октафтор-6,6′-метилбифенил)боран; трис(2,2’,3,3’,5,5’,6,6’-октафтор-4,4’-бифенил)боран; трис(3,3’,4,4’,5,5’,6,6’-октафтор-2,2’-бифенил)боран; трис(2,2’,4,4’,5,5’,6,6’-октафтор-3,3’-бифенил)боран; трис(2,3,4,6-тетрафторфенил)боран; трис(2,3,5,6-тетрафторфенил)боран; трис(2,3,5-трифторфенил)боран; трис(2,3,6-трифторфенил)боран; трис(1,3-дифторфенил)боран; трис(2,3,5,6-тетрафтор-4-метилфенил)боран; трис(2,3,4,6-тетрафтор-5-метилфенил)боран; трис(2,6-дифтор-3-метилфенил)боран; трис(2,4-дифтор-5-метилфенил)боран; трис(3,5-дифтор-2-метилфенил)боран; фторбис(пентафторфенил)боран; хлорбис(пентафторфенил)боран; дихлор(пентафторфенил)боран; дифтор(пентафторфенил)боран; 9-хлор-9-борперфторфлуорен; 9-метил-9-борперфторфлуорен; 9-пентафторфенил-9-борперфторфлуорен и 9-бром-9-борперфторфлуорен. Другой целью настоящего изобретения является каталитическая система для полимеризации олефинов, включающая продукт, получаемый введением в контакт: (A) по крайней мере одного металлоорганического соединения переходного металла, за исключением пирролидил-бис ( (B) металлоорганического соединения, получаемого введением в контакт (а) соединения, имеющего следующую формулу (I): где Ra, Rb, Rc и Rd, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, галогена, линейных или разветвленных, насыщенных или ненасыщенных C1-С10 алкильных, С6-С20 арильных, С7-С20 арилалкильных и С7-С20 алкиларильных групп, необязательно содержащих атомы О, S, N, P, Si или галогена, или два или более соседних заместителя Ra, Rb, Rc и Рd образуют один или более С4-С7 циклов, необязательно содержащих атомы О, S, N, Р или Si, которые могут нести заместители; с b) кислотой Льюиса формулы (II) где Mt представляет собой металл, относящийся к 13 группе Периодической таблицы элементов (ИЮПАК); R1, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из галогена, галогенированных С6-С20-арильных и галогенированных С7-С20-алкиларильных групп; две группы R1 также могут образовывать с атомом металла Mt одно конденсированное кольцо, такое как, например, 9-борфлуореновые соединения; и (С) необязательно алкилирующего агента. Предпочтительно каталитическая система для полимеризации олефинов включает продукт, получаемый введением в контакт: (A) по крайней мере одного металлоорганического соединения переходного металла, за исключением пирролидил бис( (B) металлоорганического соединения, относящегося к классу (1) (соединения с формулами (III), (V) и (VI)) или классу (2) (соединения с формулами (IV) и (VII)), как описано выше; и (C) необязательно алкилирующего агента. Переходные металлоорганические соединения, используемые в каталитической системе по настоящему изобретению, представляют собой соединения, пригодные в качестве катализаторов полимеризации олефинов на основе координационной полимеризации или полимеризации внедрения. Этот класс включает известные соединения переходных металлов, пригодные в традиционной координационной полимеризации Циглера-Натта, а также металлоценовые соединения и соединения поздних переходных металлов, известные как пригодные для координационной полимеризации. Они обычно включают соединения переходных металлов 4-10 группы, в которых, по крайней мере, один лиганд металла может быть удален каталитическими активаторами. Как правило, когда указанный лиганд является водородом или углеводородной группой, содержащей от 1 до 20 атомов углерода, необязательно содержащей атомы кремния, металлоорганическое каталитическое соединение переходного металла может использоваться как таковое, в противном случае необходимо использовать алкилирующий агент для алкилирования указанного катализатора. Алкилирование может проводиться в отдельной стадии или in situ. Алкилирующий агент является соединением, способным вступать в реакцию с металлоорганическими каталитическими соединениями переходного металла, и заменять указанный лиганд, который может быть удален, алкильной группой. Предпочтительно указанный алкилирующий агент выбирают из группы, состоящей из R10Li, R10Na, R10K, R10MgU или AIR103-zWz или алюмоксанов, в которых R10 может быть C1-С10-алкильными, алкенильными или алкиларильными радикалами, необязательно содержащими один или несколько атомов Si или Ge, z равно 0, 1 или 2 или нецелому числу в диапазоне от 0 до 2; U является хлором, бромом или йодом, и W представляет собой атом водорода, или хлора, или брома, или йода; неограничивающими примерами R10 являются метил, этил, бутил и бензил; неограничивающими примерами AlR103–zWz являются триметилалюминий (ТМА), трис(2,4,4-триметил-пентил)алюминий (TIOA), трис(2-метил-пропил)алюминий (TIBA), трис(2,3,3-триметил-бутил)алюминий, трис(2,3-диметил-гексил)алюминий, трис-(2,3-диметил-бутил)алюминий, трис(2,3-диметил-пентил)алюминий, трис(2,3-диметил-гептил)алюминий, трис(2-метил-3-этил-пентил)-алюминий и трис (2-этил-3,3-диметил-бутил). Неограничивающими примерами алюмоксанов являются: метилалюмоксан (МАО), тетра-(изобутил)алюмоксан (TIBAO), тетра-(2,4,4-триметил-пентил)-алюмоксан) (ТIOАО), тетра-(2,3-диметилбутил) алюмоксан (TDMBAO) и тетра-(2,3,3-триметилбутил)алюмоксан (ТТМВАО). В отличие от каталитической системы, раскрываемой в WO 99/64476, каталитическая система по настоящему изобретению стабильна и может быть выделена. Предпочтительным классом металлоорганических соединений переходного металла являются металлоценовые соединения, относящиеся к следующей формуле (VIII) где (ZR7m)n является двухвалентной группой, соединяющей Ср и А; Z является С, Si, Ge, N или Р, и группы R7, одинаковые или отличающиеся друг от друга, являются водородом или линейными или разветвленными, насыщенными или ненасыщенными C1-C20-алкильными, С3-С20-алкильными, С6-С20-арильными, С7-С20-алкиларильными и С7-С20-арилалкильными группами или два R7 могут образовывать алифатическое или ароматическое С4-С7 кольцо; Ср является замещенной или незамещенной циклопентадиенильной группой, необязательно конденсированной с одним или несколькими замещенными или незамещенными, насыщенными, ненасыщенными или ароматическими кольцами, содержащими от 4 до 6 атомов углерода, необязательно содержащими один или несколько гетероатомов; А представляет О, S, NR8, PR8, в которых R8 является водородом, линейным или разветвленным, насыщенным или ненасыщенным С7-С20-алкилом, С3-С20-циклоалкилом, С6-С20-арилом, C7-C20-алкиларилом или С7-С20-арилалкилом или А имеет то же значение, что и Ср; М является переходным металлом, относящимся к 4, 5 группе или лантаноидной или актиноидной группам Периодической системы элементов (версия ИЮПАК); заместители L, одинаковые или отличающиеся друг от друга, являются моноанионными сигма лигандами, выбираемыми из группы, состоящей из водорода, галогена, R9, OR9, OCOR9, SR9, NR92 и PR92, в которых R9 является линейной или разветвленной, насыщенной или ненасыщенной С1-С20-алкильной, С3-С20-циклоалкильной, С6-С20-арильной, С7-С20-алкиларильной или С7-С20-арилалкильной группой, необязательно содержащей один или несколько атомов Si или Ge; предпочтительно заместители L одинаковые; m равняется 1 или 2 и, в особенности, равно 1, если Z является N или Р, и равняется 2, если Z является С, Si или Ge; n является целым числом от 0 до 4; r равняется 0, 1 или 2; предпочтительно 0 или 1; n равняется 0, если r равняется 0; р является целым числом, равным степени окисления металла М минус r+1; т.е. минус 3, если r=2, минус 2, если r=1, и минус 1, если r=0, и изменяется от 1 до 4. В металлоценовом соединении формулы (VIII) двухвалентный мостик (ZR7m)n предпочтительно выбирают из группы, состоящей из CR72, (CR72)2, (CR72)3, SiR72, GeR72, NR7 и PR7, R7 имеют указанные выше значения; предпочтительно указанный двухвалентный мостик представляет собой Si(СН3)2, SiPh2, CH2, (CH2)2, (CH2)3 или С(СН3)2. Переменная m предпочтительно равняется 1 или 2; переменная n предпочтительно изменяется от 0 до 4 и, если n>1, атомы Z могут быть одинаковыми или отличающимися друг от друга, такими как двухвалентные мостики CH2-O, CH2-S и СН2-Si(СН3)2. Лиганд Ср, который Группа А является О, S, N(R8), в которой R8 является водородом, линейным или разветвленным, насыщенным или ненасыщенным C1-C20 алкилом, С3-С20 циклоалкилом, С6-С20 арилом, С7-С20 алкиларилом или С7-С20 арилалкилом, предпочтительно R8 является метилом, этилом, н-пропилом, изопропилом, н-бутилом, трет-бутилом, фенилом, n-(н-бутил)-фенилом, бензилом, циклогексилом и циклододецилом; более предпочтительно R8 является трет-бутилом; или А имеет то же значение, что и Ср. Неограничивающими примерами, относящимися к формуле (VIII), являются рацемические или мезо формы (если существуют) следующих соединений: бис(циклопентадиенил)цирконий диметил; бис(инденил)цирконий диметил; бис(тетрагидроинденил)цирконий диметил; бис-(флуоренил)цирконий диметил; (циклопентадиенил)(инденил)цирконий диметил; (циклопентадиенил)(флуоренил)цирконий диметил; (циклопентадиенил)(тетрагидроинденил)цирконий диметил; (флуоренил) (инденил)цирконий диметил; диметилсиландиилбис(инденил)цирконий диметил, диметилсиландиилбис(2-метил-4-фенил-инденил)цирконий диметил, диметилсиландиилбис(4-нафтилинденил)цирконий диметил, диметилсиландиилбис(2-метилинденил)-цирконий диметил, диметилсиландиилбис(2-метил-4-третбутилинденил)цирконий диметил, диметилсиландиилбис(2-метил-4-изо-пропилинденил)цирконий диметил, диметилсиландиилбис(2,4-диметилинденил)цирконий диметил, диметилсиландиилбис(2-метил-4,5-бензоинденил)цирконий диметил, диметилсиландиилбис(2,4,7-триметилинденил)цирконий диметил, диметилсиландиилбис(2,4,6-триметилинденил)цирконий диметил, диметилсиландиилбис(2,5,6-триметилинденил)цирконий диметил, метил(фенил)силандиилбис(2-метил-4,6-диизопропилинденил)цирконий диметил, метил(фенил)силандиилбис (2-метил-4-изопропилинденил)цирконий диметил, 1,2-этиленбис(инденил)цирконий диметил, 1,2-этиленбис(4,7-диметил-инденил)цирконий диметил, 1,2-этиленбис(2-метил-4-фенилинденил)цирконий диметил, 1,4-бутандиилбис(2-метил-4-фенилинденил)-цирконий диметил, 1,2-этиленбис(2-метил-4,6-диизопропилинденил) цирконий диметил, 1,4-бутандиилбис(2-метил-4-изопропилинденил)цирконий диметил, 1,4-бутандиилбис(2-метил-4,5-бензоинденил)цирконий диметил, 1,2-этиленбис(2-метил-4,5-бензоинденил)цирконий диметил, [4-( Если А является N(R8), подходящий для использования в каталитических комплексах по изобретению класс металлоценовых комплексов (А) включает хорошо известные катализаторы с фиксированной геометрией, описанные в ЕР-А-0416815, ЕР-А-0420436, ЕР-А-0671404, ЕР-А-0643066 и WO-A-91/04257. Согласно предпочтительному исполнению изобретения группа А имеет то же значение, что и Ср, и предпочтительно является замещенным или незамещенным циклопентадиенилом, инденилом, тетрагидроинденил (2,5-диметил-циклопента[1,2-b:4,3-b’]-дитиофеном). Пригодные металлоценовые комплексы, которые могут использоваться в каталитической системе согласно настоящему изобретению, описаны в WO 98/22486, WO 99/58539, WO 99/24446, USP 5556928, WO 96/22995, ЕР-485822, ЕР-485820, USP 5324800 и ЕР-А-0129 368. Металл М предпочтительно представляет собой Ti, Zr или Hf и более предпочтительно Zr. Заместители L предпочтительно одинаковые и их выбирают из группы, состоящей из галогенов, R9, OR9 и NR92; где R9 является C1-C7 алкильной, C6-C14 арильной или C7-C14 арилалкильной группой, необязательно содержащей один или несколько атомов Si или Ge; более предпочтительно заместители L выбирают из группы, состоящей из -Cl, -Br, -Me, -Et, -н-Bu, -втор-Bu, -Ph, -Bz, -CH2SiMe3, -OEt, -OPr, -OBu, -OBz и NMe2, еще более предпочтительно L является метилом. Целое число n изменяется от 0 до 4, и оно предпочтительно равно 1 или 2. Если n=0 и r=1, А может иметь то же значение, что и Ср; Ср и А предпочтительно являются пентаметил циклопентадиенильной, инденильной или 4,5,6,7-тетрагидроинденильной группой. Неограничивающими примерами этих металлоценовых комплексов являются:
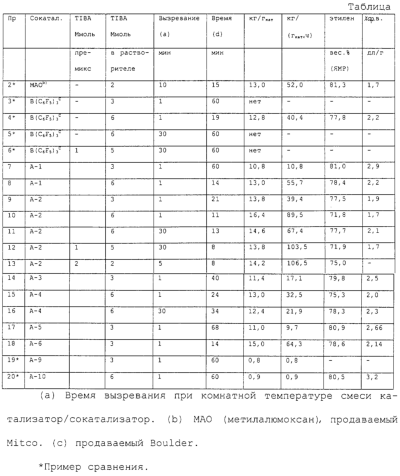
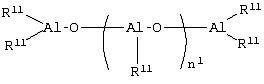
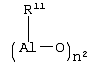
и соответствующие –NMe2, М(ОМе)2, -МН2, -МНСl, -MMeOMe, -MMeOEt, -MMeOCH2Ph, -MMeOPh, -M(OEt)2, -MCl(OMe), -MCl(OEt), -MPh2, -MBz2, -MMeCl, -MPhCl, -M(NMe2)2 и -M(NMe2)OMe производные, в которых Ме= метил, Et= этил, Ср= циклопентадиенил, Ind= инденил, H4Ind=4,5,6,7-тетрагидроинденил, Рh=фенил, Вz=бензил и М предпочтительно является Zr. Если n=1 или 2 и r=1, Ср и А, одинаковые или отличающиеся друг от друга, предпочтительно являются циклопентадиенилом, тетраметил-циклопентадиенилом, инденилом, 4,5,6,7-тетрагидроинденилом, 2-метил-4,5,6,7-тетрагидроинденилом, 4,7-диметил-4,5,6,7-тетрагидроинденилом, 2,4,7-триметил-4,5,6,7-тетрагидроинденилом, или флуоренильными группами; (ZR7m)n (предпочтительно являются Me2Si, Me2C, CH2 или C2H4. Неограничивающими примерами металлоценовых комплексов формулы (II), в которых n=1 или 2 и r=1, являются: и соответствующие -MMe2, -M(OMe)2 -M(OEt)2 -MCl(OMe), -MCl(OEt), -MPh2, -MBz2, -MMeCl, -MPhCl, -M(NMe2)2 и -M(NMe2)OMe производные, в которых Me, Cp, Ind, Flu, Ph, Bz, H4Ind и М имеют значения, указанные выше. Пригодными металлоценовыми комплексами (А) являются бисинденильные металлоцены с мостиковыми группами, как описано, например, в USP 5145819 и ЕР-А-0485823. Дополнительными металлоценовыми комплексами, пригодными для каталитической системы по изобретению, являются классы гетероциклических металлоценов, описанные в WO 98/22486 и WO 99/24446. Среди этих металлоценов в особенности предпочтительны те, которые указываются со страницы 15 строка 8 до страницы 24 строка 17; со страницы 25 строка 1 до страницы 31 строка 9; и со страницы 58 предпоследняя строка до страницы 63 строка 20 в WO 98/22486. Другими предпочтительными металлоценами являются те, которые получают из мостиковых лигандов, перечисленных со страницы 11 строка 18 до страницы 14 строка 13 МО 99/24446. Еще одним дополнительным классом каталитических металлоорганических соединений переходного металла являются комплексы поздних переходных металлов формул (IX) или (X) в которых М3 является металлом, относящимся к 8,9,10 или 11 группе Периодической таблицы элементов (новая форма записи ИЮПАК); La является бидентатным или тридентатным лигандом формулы (XI): где: В является C1-C50 мостиковой группой, соединяющей Е1 и Е2, необязательно содержащей один или более атомов, относящихся к 13-17 группам Периодической таблицы; Е1 и Е2, одинаковые или отличающиеся друг от друга, являются элементами, относящимися к 15 или 16 группе Периодической таблицы, и связаны с указанным металлом Мa; заместители Ra1, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, линейных или разветвленных, насыщенных или ненасыщенных C1-C20 алкильных, С3-С20 циклоалкильных, C6-C20 арильных, С7-С20 алкиларильных и С7-С20 арилалкильных радикалов, необязательно содержащих один или более атомов, относящихся к 13-17 группам Периодической таблицы элементов (таких как атомы В, Al, Si, Ge, N, Р, О, S, F и Cl); или два заместителя Ra1, присоединенные к одному атому Е1 или Е2, образуют насыщенное, ненасыщенное или ароматическое C4-C7 кольцо, имеющее от 4 до 20 атомов углерода; ma и na независимо равняются 0, 1 или 2, в зависимости от валентности Е1 и Е2, так чтобы удовлетворять валентности Е1 и Е2; qa является зарядом бидентатного или тридентатного лиганда, так чтобы он удовлетворял степени окисления MaXapa или МaАa, и соединения (IX) или (X) были в целом нейтральными; Xa, одинаковые или отличающиеся друг от друга, являются моноанионными сигма лигандами, выбираемыми из группы, состоящей из водорода, галогена, Ra, ORa, ОSО2СF3, OCORa, SRa, -NRa2 и PRa2 групп, в которых заместители Ra являются линейными или разветвленными, насыщенными или ненасыщенными, C1-С20 алкильными, С3-С20 циклоалкильными, С6-С20 арильными, C7-C20 алкиларильными или С7-С20 арилалкильными радикалами, необязательно содержащими один или более атомов, относящихся к 13-17 группам Периодической таблицы элементов (новая форма записи ИЮПАК), такие как атомы В, N, Р, Al, Si, Ge, О, S и F; или две Xa группы образуют металлациклическое кольцо, содержащее от 3 до 20 атомов углерода; заместители Xa предпочтительно одинаковые; рa является целым числом от 0 до 3, так чтобы конечное соединение (IX) или (X) было в целом нейтральным; и Аa является Неограничивающими примерами комплексов поздних переходных металлов являются те, которые описаны в WO 96/23010, WO 97/02298, WO 98/40374 и J.Am.Chem.Soc. 120:4049-4050, 1998. Brookhart et al., J. Am. Chem. Soc. 1995, 117, 6414 и Brook-hart et al., J. Am. Chem. Soc. 1996, 118, 267, Brookhart et al., J. Am. Chem. Soc. 1998, 120, 4049, Gibson et al., Chem. Commun. 1998, 849, WO 96/27439 и Chem. Ber./Recl. (1997), 130(3), 399-403. Следующей целью настоящего изобретения является способ полимеризации одного или нескольких олефинов в присутствии описанной выше каталитической системы. Металлоорганические соединения согласно изобретению обладают хорошей активностью в качестве сокатализаторов в способах полимеризации олефинов. Кроме того, их легко получить, и они не приводят к выделению нежелательных побочных продуктов после активации металлоцена. Кроме того, они стабильны и дают стабильные каталитические композиции в условиях полимеризации. Металлоорганические соединения по изобретению легко получить реакцией примерно стехиометрических количеств соединения формулы (I): где Ra, Rb, Rc и Rd те же, что и описано выше; с льюисовской кислотой формулы (II) где Mt и R1 описаны выше. Реакцию между указанной льюисовской кислотой и соединением формулы (I) предпочтительно проводят в апротонном растворителе, более предпочтительно в полярном апротонном растворителе (таком как толуол, диэтиловый эфир или CH2Cl2), при комнатной температуре, реакция может также проводиться в присутствии небольшого количества воды, предпочтительно равного или меньшего, чем один мольный эквивалент по отношению к льюисовской кислоте. Кислотность льюисовской кислоты должна быть достаточно высокой, чтобы вызвать миграцию водорода от атома N к атому С в Мольное отношение металлоорганического соединения (В) и металлоорганического каталитического соединения переходного металла (А), рассчитанное как мольное отношение между металлом Mt льюисовской кислоты и металлом каталитического металлоорганического соединения переходного металла, предпочтительно изменяется в диапазоне от 10:1 до 1:10, более предпочтительно от 2:1 до 1:2 и еще более предпочтительно примерно 1:1. Согласно изобретению соединение (В) может в подходящем случае включать смесь двух или более металлоорганических соединений по изобретению. Более того, компонент (В) может использоваться в комбинации с другими совместными сокатализаторами, известными в данной области техники, такими как алюмоксановые соединения. Каталитическая система по изобретению может также включать одно или несколько алюминиевых соединений формулы AlR103-zWz, действующих как поглотитель, в которых R10 может быть C1-С10-алкильными, алкенильными или алкиларильными радикалами, необязательно содержащими один или несколько атомов Si или Ge, z представляет собой 0, 1 или 2 или не целое число, изменяющееся в диапазоне от 0 до 2; U представляет собой атом хлора, брома или йода и W является водородом, хлором, бромом или йодом; неограничивающими примерами алюминиевых соединений являются триметилалюминий (ТМА), трис(2,4,4-триметил-пентил)-алюминий (TIOA), трис(2-метил-пропил)алюминий (TIBA), трис(2,3,3-триметил-бутил)алюминий, трис(2,3-диметил-гексил)-алюминий, трис(2,3-диметил-бутил)алюминий, трис(2,3-диметил-пентил)алюминий, трис(2,3-диметил-гептил)алюминий, трис (2-метил-3-этил-пентил)алюминий и трис(2-этил-3,3-диметил-бутил). Другим примером соединения, которое может действовать как поглотитель являются алюмоксановые соединения, содержащие по крайней мере одну группу типа: где заместители R11, которые могут быть одинаковыми или различными, описаны выше. В частности, алюмоксаны формулы: могут использоваться в случае линейных соединений, в которых n1 является 0 или целым числом от 1 до 40 и заместители R15 описаны выше, или алюмоксаны формулы: могут использоваться в случае циклических соединений, в которых n2 является целым числом от 2 до 40 и заместители R11 определены выше. Примерами алюмоксанов, пригодных в качестве поглотителей согласно настоящему изобретению, являются метилалюмоксан (МАО), тетра-(изобутил)алюмоксан (TIBAO), тетра-(2,4,4-триметил-пентил) алюмоксан) (ТIOАО), тетра-(2,3-диметилбутил)-алюмоксан (TDMBAO) и тетра-(2,3,3-триметилбутил)алюмоксан (ТТМВАО). В особенности интересными алюмоксанами являются те, которые описаны в WO 99/21899. Каталитическая система по изобретению может быть получена перед его введением в реактор полимеризации или in situ в реакторе путем приведения в контакт описанных выше компонент (A), (В) и необязательно (С). Согласно варианту реализации изобретения компоненты (А), (B) и необязательно (С) вначале вводят в контакт и затем вводят в реактор, в который были раздельно введены алюминиевое соединение AlR103-zWz или алюмоксан. В качестве альтернативы компоненты (А), (В) и необязательно (С) и указанное алюминиевое соединение AlR103-zWz или указанный алюмоксан могут быть приведены в контакт друг с другом перед их введением в реактор. Катализаторы по настоящему изобретению могут использоваться на инертных подложках. Это может быть достигнуто осаждением указанного каталитического металлоорганического соединения переходного металла (А) или продукта его реакции с металлоорганическим соединением (В) и необязательно с алкилирующим агентом (С), или указанного металлоорганического соединения, и впоследствии указанного каталитического металлоорганического соединения переходного металла, перед или после необязательной обработки указанным алкилирующим агентом, на инертные подложки, такие как диоксид кремния, оксид алюминия, сополимеры стирол/дивинилбензола, полиэтилен или полипропилен. Таким образом, полученное твердое вещество может быть подходящим образом использовано при полимеризации в газовой фазе. Катализаторы по настоящему изобретению могут использоваться в реакциях полимеризации олефинов. Таким образом, согласно следующей цели, в изобретении предлагается способ полимеризации одного или нескольких олефинов, включающий приведение в контакт одного или нескольких олефинов в условиях полимеризации в присутствии описанной выше каталитической системы. Олефины, которые могут быть полимеризованы в способе настоящего изобретения, представляют собой, например, Катализаторы согласно настоящему изобретению могут подходящим образом использоваться при гомополимеризации этилена, в особенности для получения HDPE (полиэтилен высокой плотности) и при сополимеризации этилена, в особенности для получения LLDPE. Пригодными сомономерами в этиленовых сополимерах являются Дополнительными пригодными сомономерами в указанных этиленовых сополимерах являются полиены, в особенности сопряженные или несопряженные, линейные или циклические диены, такие как 1,4-гексадиен, изопрен, 1,3-бутадиен, 1,5-гексадиен и 1,6-гептадиен. Когда металлоорганические соединения, являющиеся целью настоящего изобретения, используются в качестве сокатализатора в сополимеризации этилена, они в общем создают полимер, имеющий более высокий молекулярный вес, по сравнению с алюмоксанами, в особенности метилалюмоксаном. Катализаторы по изобретению могут подходящим образом использоваться при гомополимеризации пропилена, в особенности при производстве изотактического полипропилена. Кроме того, катализаторы по изобретению могут подходящим образом использоваться при получении эластомерных сополимеров этилена с Согласно еще одному варианту реализации катализаторы согласно настоящему изобретению используются при получении циклоолефиновых полимеров. Моноциклические и полициклические олефиновые мономеры могут быть либо гомополимеризованы или сополимеризованы также и с линейными олефиновыми мономерами. Процессы полимеризации по настоящему изобретению могут проводиться в жидкой фазе, необязательно в присутствии инертного углеводородного растворителя, или в газовой фазе. Указанный углеводородный растворитель может быть или ароматическим (таким как толуол) или алифатическим (таким как пропан, гексан, гептан, изобутан, циклогексан и 2,2,4-триметилпентан). Температура полимеризации предпочтительно изменяется от 0°С до 250°С; при получении HDPE и LLDPE, она предпочтительно находится между 20°С и 150°С и в особенности между 40°С и 90°С; при получении эластомерных сополимеров она предпочтительно находится между 0°С и 200°С и в особенности предпочтительно между 20°С и 100°С. Молекулярный вес полимеров может легко изменяться путем изменения температуры полимеризации, типа или концентрации каталитических компонентов или при использовании регуляторов молекулярной массы, таких как водород. Молекулярно-массовое распределение может быть изменено при использовании смесей различных металлоценовых комплексов или путем проведения полимеризации в несколько стадий, которые различаются по температуре полимеризации и/или концентрациям регуляторов молекулярной массы. Выход полимеризации зависит от чистоты металлоорганического каталитического соединения переходного металла (А) в катализаторе, поэтому указанное соединение может использоваться, как оно есть, или может подвергаться очистке перед использованием. Следующие неограничивающие примеры приведены для иллюстрации. Общая методика и идентификация Все операции проводились в атмосфере азота при использовании обычных методик с применением линии Шленка. Растворители очищали дегазированием N2 и пропусканием над активированным (8 часов, продувка N2, 300°C) Аl2O3 и хранили в азотной атмосфере. Индол (Aldrich, чистота 98% или Fluka чистота 99%), 2-метилиндол (Aldrich, чистота 98%), 3-метилиндол (Aldrich, чистота 98%), пиррол (Aldrich, чистота 98%), 2,4-диметилпиррол (Aldrich, чистота 97%), 2,5-диметилпиррол (Aldrich, чистота 98%), 2-этилпиррол (Aldrich, чистота 90%), 4,5,6,7-тетрагидроиндол (Aldrich, чистота 98%), ВСl3 (Aldrich, 1,0 М раствор в гептане) и В(С6F5)3 (Boulder Scientific Company) использовали в поставляемом виде. 2-метил-5,6-дигидроиндено[2, 1-b] индол синтезировали в лаборатории заявителей согласно способу, описанному в патенте WO 99/24446. Температуры плавления соединений получали при использовании капиллярного прибора Electrochemical. 1H-ЯМР и 13С-ЯМР Протонные и углеродные спектры соединений получали на спектрометре Bruker DPX 200, работающем в режиме преобразования Фурье при комнатной температуре при 200,13 МГц и 50,33 МГц соответственно. Образцы растворяли в СDСl3, СD2Сl2 или C6D6. В качестве стандарта использовали остаточный пик СНСl3 или CHDCl2 или С6НO5 в 1H спектре (7,25 м.д., 5,35 м.д. и 7,15 м.д. соответственно) и пик растворителя в 13С спектре (53,80 м.д. для CD2Cl2 и 128,00 м.д. для C6D6). Протонный спектр получали с импульсом 15° и 2-секундной задержкой между импульсами; для каждого спектра накапливали 32 прохода. Углеродный спектр получали импульсом 45° и 6-секундной задержкой между импульсами; для каждого спектра накапливали примерно 512 проходов. CD2Cl2 (Aldrich, чистота 99,8% атом D) использовали в поставляемом виде, тогда как СDСl3 (Aldrich, чистота 99,8% атом D) и C6D6 (Aldrich, чистота 99% атом D) перед использованием сушили над активированными 4 Синтез металлоорганических соединений бора Пример 1 N-[трис(2,3,4,5,6-пентафторфенил)боран]3Н-индол (А-2) Способ а) Индол (99%, 1,07 г, MM (молекулярная масса) = 117,15, 9,0 ммоль) растворяли в 10 мл CH2Cl2 и загружали в 50 мл сосуд Шленка в атмосфере азота. Раствор В(С6F5)3 (4,61 г, ММ = 511,99, 9,0 ммоль) в 25 мл CH2Cl2 добавляли при комнатной температуре при перемешивании. Во время добавления цвет раствора мгновенно изменялся с желтоватого на янтарно-желтый; выделение тепла не наблюдалось. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем растворитель удаляли под вакуумом с получением в качестве продукта беловатого твердого вещества (5,32 г). Выход=94,4%. 1H ЯМР (CD2Cl2, 13С ЯМР (CD2Cl2, Т.пл.=203,9°С-206,7°С. Способ б) Раствор индола (99%, 0,72 г, ММ = 117,15, 6,05 ммоль) в 5 мл Et2O добавляли при -20°С в атмосфере азота к суспензии В(С6F5)3 (99,4%, 3,13 г, ММ = 511,99, 6,08 ммоль) в 20 мл этилового эфира в 50 мл сосуде Шленка. Во время добавления цвет раствора изменялся с беловатого на желтый. Реакционную смесь затем оставляли нагреваться до комнатной температуры и перемешивали в течение 2 часов с окончательным образованием желтого раствора. 1H ЯМР анализ показал, что реакция завершилась уже через 1 час перемешивания при комнатной температуре. Растворитель упаривали в вакууме с получением в качестве продукта светло-желтого твердого вещества (выход 100%). 1H ЯМР (СDСl3, Пример 2 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]3-метил-3Н-индола (A-4) Раствор 3-метилиндола (98%, 0,92 г, ММ = 131,18, 6,87 ммоль) в 10 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к раствору В(С6F5)3 (BSC-382-4-0128, 99,4%, 3,53 г, ММ = 511,99, 6,85 ммоль) в 15 мл дихлорметана в 50 мл сосуде Шленка. Выделения тепла не наблюдалось. Во время добавления цвет раствора изменялся со светло-желтого на желтый. Через 30 мин перемешивания при комнатной температуре 1H ЯМР анализ показал наличие следов непрореагировавшего 3-метилиндола. Затем для завершения реакции добавляли 0,23 г (0,45 ммоль) трис(2,3,4,5,6-пентафторфенил)борана. После перемешивания в течение ночи растворитель удаляли под вакуумом с получением в качестве продукта белого порошка (выход 100%). 1H ЯМР (CD2Cl2, 1H ЯМР (С6D6, 13С ЯМР (С6D6, Комплекс 3-метил-3Н-индол·В(С6F5)3 показывает наличие двух диастереоизомеров при 10°С в CD2Cl2. Отношение этих двух диастереоизомеров составляет 55:45 при 10°С в CD2Cl2. Пример 3 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]2-метил-ЗН-индола (А-3) Раствор 2-метилиндола (98%, 0,67 г, ММ = 131,18, 5,01 ммоль) в 10 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к раствору В(С6F5)3 (99,4%, 2,60 г, ММ = 511,99, 5,05 ммоль) в 15 мл дихлорметана в 50 мл сосуде Шленка. Выделения тепла не наблюдалось. Во время добавления цвет раствора изменился со светло-оранжевого на оранжевый. 1H ЯМР анализ в CD2Cl2 показал количественное превращение исходного 2-метилиндола через 1 ч перемешивания при комнатной температуре. Через 4 ч перемешивания при комнатной температуре реакционная смесь стала светло-розовой суспензией. Перемешивание продолжали в течение ночи и затем суспензию фильтровали через фритту G3. Остаток на фритте был белым твердым веществом и согласно 1H ЯМР анализу в C6D6 был заданным продуктом (2,16 г, выход 67,0%). Конечный комплекс неполностью растворялся в CD2Cl2, но полностью растворялся в C6D6. 1H ЯМР (С6D6, 13С ЯМР (С6D6, Т.пл.=204,3°С-204,5°С. Пример 4 Синтез N-(трихлорборан)3Н-индола (А-20) Раствор индола (99%, 1,79 г, ММ = 117,15, 15,13 ммоль) в 20 мл дихлорметана добавляли в течение 5 мин при -20°С в атмосфере азота к раствору ВСl3 (1М в гептане, 15 мл, 15,0 ммоль) в 15 мл дихлорметана в 100 мл сосуде Шленка. В конце добавления образовывалась желтая суспензия. Реакционную смесь выдерживали при -20°С в течение 15 мин и затем оставляли нагреваться до комнатной температуры. Цвет суспензии медленно изменялся с желтого на розовый. 1Н ЯМР анализ показал, что реакция уже завершилась через 1 час перемешивания при комнатной температуре. Через 4 ч перемешивания при комнатной температуре суспензию отфильтровывали на фритте G4 и остаток сушили с получением розового порошка, который согласно 1H ЯМР анализу в CD2Cl2 представлял собой заданный продукт (2,79 г, выход 79,4%). 1H ЯМР (CD2Cl2, 1H ЯМР (C2D2Cl4, Т.пл.=184,8-185,6°С. Синтез N-(трихлорборан)3Н-гидроиндола также проводили при использовании тех же описанных выше условий, но при добавлении раствора трихлорида бора в гептане к раствору индола в дихлорметане, с получением тех же результатов. Пример 5 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]-2Н-4,5,6,7-тетрагидроиндола (А-13) Раствор 4,5,6,7-тетрагидроиндола (98%, 0,65 г, ММ = 121,18, 5,25 ммоль) в 3 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к раствору В(С6F5)3 (99,4%, 2,69 г, ММ = 511,99, 5,25 ммоль) в 15 мл дихлорметана в 25 мл сосуде Шленка. Наблюдалось небольшое выделение тепла. Реакционную смесь перемешивали в течение 30 мин при комнатной температуре и затем растворитель упаривали в вакууме с получением белого порошка в качестве продукта (выход 100%). 1H ЯМР (CD2Cl2, 13С ЯМР (CD2Cl2, Пример 6 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]-2-метил-6,10b-дигидроиндено [2,1-b] индола (А-21) 2-метил-5,6-дигидроиндено[2,1-b]индол (1,77 г, ММ = 219,29, 8,1 ммоль) растворяли в 10 мл CH2Cl2 и загружали в 50 мл сосуд Шленка в атмосфере азота. Раствор В(С6F5)3 (4,14 г, ММ = 511,99, 8,1 ммоль) в 25 мл СН2Сl2 добавляли при комнатной температуре при перемешивании. В ходе добавления цвет раствора мгновенно менялся с зеленого на темно-коричневый; выделения тепла не наблюдалось. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, затем растворитель удаляли под вакуумом с получением коричневого твердого вещества в качестве продукта (5,90 г). Выход = 100%. 1H ЯМР (CD2Cl2, 13С ЯМР (CD2Cl2, Т.пл.=160,5°С-166,1°С. Пример 7 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]5Н-пиррола (А-1) Способ а) Желто-оранжевый раствор пиррола (98%, 0,35 г, ММ = 67,09, 5,11 ммоль) в 10 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к желто-оранжевому раствору В(С6F5)3 (99,4%, 2,64 г, ММ = 511,99, 5,12 ммоль) в 40 мл дихлорметана в 100 мл сосуде Шленка. Выделения тепла не наблюдалось. Полученную таким образом желтую реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем растворитель удаляли под вакуумом с получением беловато-светло-желтого порошка в качестве продукта (выход 100%). 1H ЯМР (CD2Cl2, 13С ЯМР (CD2Cl2, NOESY (CD2Cl2): 1H ЯМР (С6D6, 13С ЯМР (С6D6, NOESY (С6D6): Т.пл.=187,0°С-189,6°С. Способ b) Светло-желтый раствор В(С6F5)3 (1,182 г, ММ = 511,99, 2,31 ммоль) в 8 мл толуола добавляли при комнатной температуре к желтому раствору пиррола (98%, 0,158 г, ММ = 67,09, 2,30 ммоль) в 2 мл толуола в атмосфере азота в 25 мл сосуде Шленка. Выделения тепла не наблюдалось. Полученную таким образом желтую реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем растворитель удаляли под вакуумом с получением желтого порошка в качестве продукта (1,255 г, чистота 99,5%, выход 93,8%). Пример 8 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]-2,4-диметил-5Н-пиррола (А-5) Желто-оранжевый раствор 2,4-диметилпиррола (97%, 0,564 г, ММ = 95,15, 5,75 ммоль) в 5 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к светло-желтому раствору В(С6F5)3 (99,4%, 3,267 г, ММ = 511,99, 6,34 ммоль) в 20 мл дихлорметана в 50 мл сосуде Шленка. Выделения тепла не наблюдалось. Желтую реакционную смесь перемешивали в течение 20 ч при комнатной температуре и анализировали 1Н ЯМР в различные моменты времени. Конечный желтый раствор сушили в вакууме с получением темно-желтого порошка в качестве продукта (выход 100%). 1H ЯМР (CD2Cl2, 1H ЯМР (С6D6, 13С ЯМР (CD2Cl2, NOESY (CD2Cl2): Т.пл.=209,2-211,8°С. Пример 9 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]-2,5-диметил-5Н-пиррола (А-6) Розовый раствор 2,5-диметилпиррола (98%, 0,313 г, ММ = 95,15, 3,22 ммоль) в 8 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к светло-желтому раствору В(С6F5)3 (99,4%, 1,659 г, ММ = 511,99, 3,22 ммоль) в 15 мл дихлорметана в 25 мл сосуде Шленка. Выделения тепла не наблюдалось. Реакционную смесь перемешивали в течение 5 ч при комнатной температуре и анализировали посредством 1H ЯМР в различные моменты времени. Конечный светло-оранжевый раствор сушили в вакууме с получением желтого порошка в качестве продукта (1,878 г, выход 96,1%). Согласно ЯМР анализу продукт представлял собой смесь N-[трис(2,3,4,5,6-пентафторфенил)боран]-2,5-диметил-5-гидропиррола (90%) и N-[трис(2,3,4,5,6-пентафторфенил)боран]-2,5-диметил-3-гидропиррола (10%). N-[трис(2,3,4,5,6-пентафторфенил)боран]-2,5-диметил-5-гидропиррол: 1H ЯМР (CD2Cl2, 1H ЯМР (С6D6, 13С ЯМР (CD2Cl2, NOESY (CD2Cl2): N-[трис(2,3,4,5,6-пентафторфенил)боран]-2,5-диметил-3-гидропиррол: 1H ЯМР (CD2Cl2, 1H ЯМР (С6D6, Пример 10 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]-2-этил-5Н-пиррола (А-7) Оранжевый раствор 2-этилпиррола (90%, 0,367 г, ММ = 95,15, 3,47 ммоль) в 5 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к светло-желтому раствору В(С6F5)3 (99,4%, 1,80 г, ММ = 511,99, 3,49 ммоль) в 15 мл дихлорметана в 25 мл сосуде Шленка. В ходе добавления цвет раствора мгновенно изменялся с оранжевого на темно-оранжевый; выделения тепла не наблюдалось. Реакционную смесь перемешивали в течение ночи при комнатной температуре: 1H ЯМР анализ показал наличие примерно 11% мольн. непрореагировавшего 2-этилпиррола. Затем для завершения реакции добавляли 0,21 г (0,41 ммоль) трис (2,3,4,5,6-пентафторфенил)борана. После нескольких минут перемешивания растворитель удаляли под вакуумом с получением белого порошка в качестве продукта (выход 100%). 1H ЯМР (CD2Cl2, 1H ЯМР (С6D6, 13С ЯМР (CD2Cl2, Пример 11 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]-имидазола (А-9) Бесцветный раствор имидазола в 5 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к светло-желтому раствору В(С6F5)3 (99,4%, 1,80 г, ММ = 511,99, 3,49 ммоль) в 15 мл дихлорметана в 25 мл сосуде Шленка. В ходе добавления цвет раствора мгновенно изменялся с оранжевого на темно-оранжевый; выделения тепла не наблюдалось. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, затем растворитель удаляли под вакуумом с получением белого порошка (2,60 г) в качестве продукта (выход 100%). 1H ЯМР (CD2Cl2, 13C ЯМР (CD2Cl2, Т.пл.=214,9°С-217,8°С. Пример 12 Синтез N-[трис(2,3,4,5,6-пентафторфенил)боран]-пирролидина (А-10) Раствор пирролидина (99,5%, 0,34 г, ММ = 71,12, 4,78 ммоль) в 3 мл дихлорметана добавляли при комнатной температуре в атмосфере азота к раствору трис(2,3,4,5,6-пентафторфенил)борана (BSC-382-4-0128, 99,4%, 2,44 г, ММ = 511,99, 4,77 ммоль) в 15 мл дихлорметана в 50 мл сосуде Шленка. Наблюдалось незначительное выделение тепла. Реакционную смесь перемешивали в течение 30 мин при комнатной температуре и затем растворитель упаривали в вакууме с получением белого порошка в качестве продукта (выход 100%). 1H ЯМР (CD2Cl2, 13С ЯМР (CD2Cl2, Синтез металлоценовых комплексов Синтез бис(инденил)цирконий диметила 29,6 мл 1,6 М раствора MeLi в Et20 (47,4 ммоль) добавляли при комнатной температуре к раствору 3 г индена (23,7 ммоль, Aldrich, 91,8%) в 30 мл Et2O, в течение примерно 5 минут (экзотермическая реакция). Смесь перемешивали в течение 30 минут с получением оранжевого раствора. 2,76 г ZrCl4 (11,84 ммоль) суспендировали в 30 мл пентана. Суспензию ZrCl4 в пентане быстро добавляли к раствору соли Li в Et2O (экзотермическая реакция). Полученную реакционную смесь перемешивали в течение 2 часов и затем сушили при пониженном давлении. Полученное светло-коричневое твердое вещество экстрагировали 100 мл пентана (Soxhlet, 4,5 часа) и затем фильтрат упаривали досуха при пониженном давлении с получением 3,2 г (77% выход) светло-желтого твердого вещества, которое идентифицировали 1H ЯМР как химически чистый Ind2ZrMe2. 1H ЯМР (С6D6, Синтез бис(инденил)гафний диметила 32,4 мл MeLi 1,6 М в Et20 (51,8 ммоль) добавляли при -80°С к раствору 3 г индена (Aldrich, 92%, 23,7 ммоль) в 30 мл Et2O, в течение примерно 10 минут. Реакционной смеси давали медленно нагреться до комнатной температуры и перемешивали в течение 4 часов. После этого времени раствор становился оранжевым из светло-желтого. 1,4 мл TiCl4 (Aldrich, 99%, 12,8 ммоль) растворяли в 30 мл пентана. Обе смеси охлаждали до -80°C и раствор TiCl4 быстро добавляли к раствору соли Li. Реакционной смеси давали медленно нагреться до комнатной температуры и перемешивали в течение ночи с окончательным получением темно-коричневой суспензии. Затем растворители удаляли при пониженном давлении. Полученное коричневое твердое вещество экстрагировали пентаном в аппарате Сокслета (Soxhlet). Фильтрат упаривали досуха при пониженном давлении с получением 2,2 г темно-зеленого порошка (56% выход). 1H ЯМР (С6D6, Получение каталитических систем по изобретению Каталитическая система 1 Бис(инденил)цирконий диметил (1,0 г, ММ = 351,60, 2,84 ммоль), полученный, как описано выше в синтезе 4, растворяли в 20 мл толуола в 100 мл сосуде Шленка в атмосфере азота. Раствор 1,8 г N-[трис(2,3,4,5,6-пентафторфенил)боран]-3-гидроиндола (ММ=629,14, 2,86 ммоль), полученного, как описано выше, в 20 мл толуола добавляли при комнатной температуре при перемешивании. В процессе добавления наблюдалось выделение метана и незначительного количества тепла. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и 30 минут и затем растворитель удаляли под вакуумом с получением 2,74 г оранжево-красного порошка. 1H ЯМР (С6D6, 13С ЯМР (С6D6, Каталитическая система 2 Бис(инденил)гафний диметил (0,50 г, ММ = 438,87, 1,14 ммоль), полученный, как описано выше, растворяли в 3 мл толуола в 15 мл сосуде Шленка в атмосфере азота. Раствор 0,72 г N-[трис(2,3,4,5,6-пентафторфенил)боран]-3-гидроиндола (Мм = 629,14, 1,14 ммоль), полученного, как описано выше, в 4 мл толуола добавляли при комнатной температуре при перемешивании. В процессе добавления наблюдалось выделение метана и незначительного количества тепла. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, затем растворитель удаляли под вакуумом с получением красного порошка в качестве продукта (1,20 г). 1H ЯМР (С6D6, Полимеризация Анализ полимера Углеродные спектры регистрировали при 120°С на спектрометрах Bruker DPX-400 или Bruker DPX-200, работающих в режиме преобразования Фурье при 100,61 и 50,33 МГц соответственно. Образцы растворяли в C2D2Cl4 при концентрациях 8% масс./об. Спектры получали с 90° импульсами и 12 секундной задержкой между импульсами. Для каждого спектра накапливали около 1500 или 3000 проходов в зависимости от спектрометра. Пик S Характеристическую вязкость измеряли в тетрагидронафталине (THN) при 135°С. Молекулярные массы полимеров определяли из значений вязкости. Полимеризация Пример 1 Полимеризация этилена Полимеризационный тест проводили в 1 л автоклаве из нержавеющей стали, термостатируемом с помощью Н2О/пара и очищенным продувкой этилена при 80°С. При продувке этиленом загружали в реактор 513 мл технического гексана и 1 ммоль TIBA, температуру доводили до 80°С и реактор вентилировали для удаления остаточного азота, затем создавали избыточное давление этиленом вплоть до 9,5 бар(изб.) (950 кПа). 3,52 мг каталитической системы 1, полученной, как описано выше, растворенной в 1,76 мл толуола, инжектировали в реактор посредством избыточного давления этилена через стальной сосуд и парциальное давление этилена стабилизировали на уровне 9,6 бар(абс) (960 кПа) (Робщ 11 бар(абс) (1100 кПа)). Полимеризацию проводили при 80°С в течение часа поддержанием постоянного парциального давления этилена, затем останавливали закачиванием СО в реактор и выпусканием непрореагировавшего этилена. Полимер отделяли фильтрованием и сушили при пониженном давлении при 60°С, получая таким образом 36,1 г полиэтилена, имеющего характеристическую вязкость 4,3 дл/г. Полимеризация: Примеры 2-20 В 4,25 л химический реактор с мешалкой из нержавеющей стали при 30°С загружали 2 л гексана, а затем TIBA в гексане (количества указаны в таблице 1) в качестве поглотителя. Затем в реактор подавали под давлением пропилен и этилен для достижения состава 1,2 вес.% этилена и 22,8 вес.% пропилена и затем температуру реактора повышали до 50°С. Каталитический комплекс получали быстрым смешиванием 5 мг (бис-инденилцирконий)-дихлорида в 5 мл толуола, одного эквивалента сокатализатора, растворенного в толуоле (для МАО используются 500 эквивалентов), и, если необходимо, 2 мл триизобутилалюминия (TIBA) в гексане, как представлено в таблице. Полимеризацию начинали инжектированием толуольного раствора, содержащего раствор катализатора/сокатализатора в толуоле, в автоклав посредством избыточного давления этилена, затем температуру поддерживали при 50°С и этилен непрерывно подавали в реактор для того, чтобы подержать постоянное давление. После добавления 40 г этилена полимеризацию останавливали закачиванием СО в реактор, вентиляцией и охлаждением реактора (неактивные опыты останавливали через 60 мин). Аморфный сополимер этилен/пропилена выделяли из раствора гексана осаждением в ацетоне, с последующим высушиванием при пониженном давлении при 70°С в течение 4 часов. Характеристики сополимеров представлены в таблице.
Формула изобретения
1. Металлоорганическое соединение, получаемое приведением в контакт а) соединения, имеющего следующую формулу (I): (I) где Rа, Rb, Rc и Rd, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, линейных или разветвленных, насыщенных или ненасыщенных C1-С10 алкильных групп, или два или более соседних заместителей Rа, Rb, Rc и Rd образуют одно или несколько С4-С7 колец, необязательно содержащих атомы N, которые могут нести заместители; с б) льюисовской кислотой формулы (II): где Mt представляет собой атом бора; R1, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из галогена и галогенированных С6-С20-арильных групп. 2. Металлоорганическое соединение по п.1, в котором заместители R1 выбирают из группы, состоящей из фтора, C6F5, C6F4Н, C6F3Н2, C6Н3(СF3)2 перфторбифенила, гептафторнафтила, гексафторнафтила и пентафторнафтила. 3. Металлоорганическое соединение по п.1, имеющее формулу (III) (III) где Mt представляет собой атом бора; R1, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из галогена и галогенированных С6-С20-арильных групп; и заместители R5, R4, R3 и R2, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, линейных или разветвленных, насыщенных или ненасыщенных, C1-С10-алкильных групп, или два или более соседних заместителей R2-R5 образуют одно или несколько С4-С7-колец, необязательно содержащих атомы N; при условии, что, по крайней мере, один из R5, R4, R3 и R2 отличается от водорода. 4. Металлоорганическое соединение по п.3, в котором заместители R1, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из фтора, C6F5, С6F4Н, С6F3Н2, С6Н3(СF3)2 перфторбифенила, гептафторнафтила, гексафторнафтила и пентафторнафтила; заместители R5 и R4 вместе образуют ароматическое C5-C7 кольцо, необязательно содержащее атомы N, которое может нести заместители. 5. Металлоорганическое соединение по п.3 или 4, имеющее формулу (V) (V) где заместители R1, R3 и R2 имеют значения, определенные в п.3 или 4, и заместители R6 представляют собой водород или линейные или разветвленные, насыщенные или ненасыщенные С1-С6-алкильные группы. 6. Металлоорганическое соединение по п.3 или 4, имеющее формулу (VI) (VI) где заместители R1 и R6 имеют значения, определенные в п.5. 7. Металлоорганическое соединение по п.1 или 2, имеющее следующую формулу (IV): где Mt и R1 имеют значения, определенные в пп.1 или 2; заместители R2’, R3’, R4’ и R5’, одинаковые или отличающиеся друг от друга, выбирают из группы, состоящей из водорода, линейных или разветвленных, насыщенных или ненасыщенных C1-C10-алкильных групп, или два или более соседних заместителя R2’, R3’, R4’ и R5’ образуют одно или несколько С4-С7-колец, необязательно содержащих N, которые могут нести заместители; указанные кольца могут быть алифатическими или необязательно могут содержать двойные связи, при условии, что указанные кольца не являются ароматическими. 8. Металлоорганическое соединение по п.7, имеющее формулу (VII): где заместители R1 имеют значения, определенные в п.1 или 2, и заместители R2’ и R5’, одинаковые или отличающиеся друг от друга, являются C1-C20 алкилом. 9. Каталитическая система для полимеризации олефинов, включающая продукт, получаемый приведением в контакт: (A) по меньшей мере, одного металлоорганического соединения переходного металла, за исключением пирролидил-бис( (B) металлоорганического соединения, определенного как указано в п.1; и (С) необязательно, алкилирующего агента. 10. Каталитическая система по п.9, в которой металлоорганическое соединение (В) имеет формулу (III): (III) где Mt, R1, R5, R4, R3 и R2 определены как в п.3. 11. Каталитическая система по п.9, в которой металлоорганическое соединение (В) имеет формулу (IV): где Mt, R1, R2′, R3′, R4′ и R5′ определены как в п.7. 12. Каталитическая система по любому из пп.9-11, в которой каталитическое металлоорганическое соединение переходного металла имеет следующую формулу: (Ср)(Ср)rMLp где Ср является замещенной или незамещенной циклопентадиенильной группой, необязательно сконденсированной с одним или несколькими замещенными или незамещенными, насыщенными, ненасыщенными или ароматическими кольцами, содержащими от 4 до 6 атомов углерода; М является переходным металлом, относящимся к 4 группе Периодической системы элементов (версия ИЮПАК); заместители L, одинаковые или отличающиеся друг от друга, являются моноанионными сигма-лигандами, выбираемыми из линейных или разветвленных, насыщенных или ненасыщенных С1-С20-алкильных групп; r равняется 0, 1 или 2; р является целым числом, равным степени окисления металла М минус r+1. 13. Способ получения металлоорганического соединения по любому из пп.2-8, включающий стадию реакции в апротонном растворителе, в примерно стехиометрических количествах, соединения, имеющего формулу (I) (I) где Rа, Rb, Rc и Rd определены в п.1; с льюисовской кислотой формулы (II) где Mt и R1 определены в п.1. 14. Способ гомополимеризации этилена или сополимеризации этилена и одного или нескольких альфа-олефинов, заключающийся в том, гомополимеризацию или сополимеризацию осуществляют приведением в контакт этилена и, необязательно, одного или нескольких альфа-олефинов в жидкой фазе или в газовой фазе при температуре полимеризации в интервале от 0 до 125°С и в присутствии каталитической системы по любому из пп.9-12.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 13.02.2007
Извещение опубликовано: 10.08.2010 БИ: 22/2010
|
||||||||||||||||||||||||||

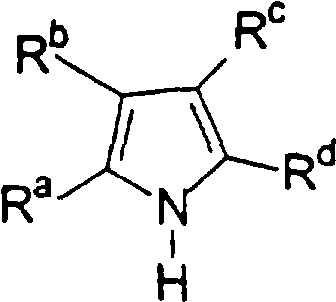 (I)
(I)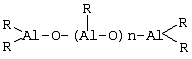
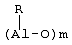

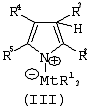
 -циклопентадиенил)метилциркония и
-циклопентадиенил)метилциркония и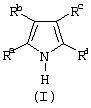

 -связан с указанным металлом М, предпочтительно выбирают из группы, состоящей из циклопентадиенила, моно-, ди-, три- и тетраметилциклопентадиенила; 4-третбутилциклопентадиенила; 4-адамантилциклопентадиенила; ин-денила; моно-, ди-, три и тетраметилинденила; 2-метилинденила, 3-третбутилинденила, 4-фенилинденила, 4,5-бензоинденила, 3-триметилсилилинденила, 4,5,6,7-тетрагидроинденила; флуоренила, 5,10-дигидроиндено[1,2-b]индол-10-ила; N-метил- или N-фенил-5,10-дигидроиндено[1,2-b]индол-10-ила; 5,6-дигидроиндено[2,1-b]индол-6-ила; N-метил- или N-фенил-5,6-дигидроиндено[2,1-b]индол-6-ила; азапентален-4-ила; тиапентален-4-ила; азапентален-6-ила; тиапентален-6-ила; моно-, ди- и триметилазапентален-4-ила; 2,5-диметил-циклопента[1,2-b:4,3b’]-дитиофена.
-связан с указанным металлом М, предпочтительно выбирают из группы, состоящей из циклопентадиенила, моно-, ди-, три- и тетраметилциклопентадиенила; 4-третбутилциклопентадиенила; 4-адамантилциклопентадиенила; ин-денила; моно-, ди-, три и тетраметилинденила; 2-метилинденила, 3-третбутилинденила, 4-фенилинденила, 4,5-бензоинденила, 3-триметилсилилинденила, 4,5,6,7-тетрагидроинденила; флуоренила, 5,10-дигидроиндено[1,2-b]индол-10-ила; N-метил- или N-фенил-5,10-дигидроиндено[1,2-b]индол-10-ила; 5,6-дигидроиндено[2,1-b]индол-6-ила; N-метил- или N-фенил-5,6-дигидроиндено[2,1-b]индол-6-ила; азапентален-4-ила; тиапентален-4-ила; азапентален-6-ила; тиапентален-6-ила; моно-, ди- и триметилазапентален-4-ила; 2,5-диметил-циклопента[1,2-b:4,3b’]-дитиофена.
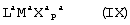
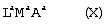
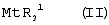
 – или
– или  -положении пиррольного кольца.
-положении пиррольного кольца.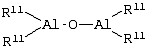
 молекулярными ситами. Получение образцов проводили в атмосфере азота при использовании стандартной методики инертной атмосферы.
молекулярными ситами. Получение образцов проводили в атмосфере азота при использовании стандартной методики инертной атмосферы.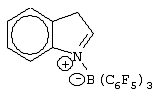
 , м.д.): 4,30 (АВ система, 2Н, Н3, Н3); 7,39-7,72 (м, 4Н, Аr); 8,83 (д, 1Н, JHF=5,0 Гц, Н2)
, м.д.): 4,30 (АВ система, 2Н, Н3, Н3); 7,39-7,72 (м, 4Н, Аr); 8,83 (д, 1Н, JHF=5,0 Гц, Н2)