Патент на изобретение №2247724
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ЗАМЕЩЕННЫЕ 1-ПИРИДИНИЛ-2-АЗОЛИЛ-1-(2-ФЕНИЛЭТЕНИЛ)ЭТАНОЛЫ-1 И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФУНГИЦИДОВ
(57) Реферат:
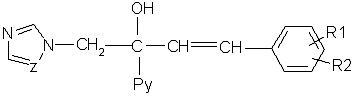
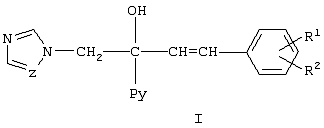
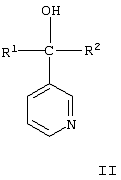
Изобретение относится к области органической химии, в частности к замещенным 1-пиридинил-2-азолил-1-(2-фенилэтенил)-этанолам-1 общей формулы I, где Ру означает 2-пиридинил, 3-пиридинил или 4-пиридинил, Z означает атом азота или группу СН, R1 и R2 независимо друг от друга означают атом водорода, галогена, трифторметильную группу и к их применению в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов для более эффективной борьбы с вредоносными грибами. 2 н. п. ф-лы, 3 табл.
Изобретение относится к химии гетероциклических соединений, а именно к замещенным 1-пиридинил-2-азолил-1-(2-фенилэтенил)этанолам-1 общей формулы I, где Рy означает 2-пиридинил, 3-пиридинил или 4-пиридинил, Z означает атом азота или группу СН, R1 и R2 независимо друг от друга означают атом водорода, галогена, трифторметильную группу, которые проявляют фунгицидную активность и могут быть использованы в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов. Известен 3,3-диметил-1-(1Н-1,2,4-триазолил-1)-1-(4-хлорфенокси)-бутанон-2, или триадимефон, который используется в качестве системного фунгицида для борьбы с болезнями пшеницы (мучнистая роса, ржавчина), яблони (мучнистая роса, парша), огурцов и дыни (мучнистая роса), виноградной лозы (оидиум, серая гниль), томатов защищенного грунта (мучнистая роса), черной смородины (американская мучнистая роса) и других культур [Справочник по пестицидам /Н.Н.Мельников, К.В.Новожилов, С.Р.Белан, Т.Н.Пылова. – М.: Химия, 1985. – 352 с.]. Известны пиридинметанолы общей формулы II, где R1 означает фенил, 4-хлорфенил или циклогексил, R2 означает С4-C8 циклоалкенил или С3-С8 циклоалкил, а также их соли, которые обладают фунгицидной активностью и могут использоваться для подавления грибов, поражающих сельскохозяйственные культуры и декоративные растения [Пат. США №3794656, кл. C 07 D 31/24 (НПК 260-290 R), 1974]. Токсичность препаратов не имеет решающего значения для их применения. Среди сельскохозяйственных фунгицидов известны малотоксичный дихлоран (ЛД50 для крыс 4000 мг/кг перорально) и высокотоксичный эдифенфос (ЛД50 для крыс 150 мг/кг перорально) [Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. Пестициды и регуляторы роста растений. – М.: Химия, 1995. – 576 с.]. Техническая задача, решаемая настоящим изобретением, состоит в расширении ассортимента фунгицидов для более эффективной борьбы с вредоносными грибами. Для решения этой задачи синтезируют замещенные 2-азолил-1-(2-арилэтенил)пиридинилэтанолы общей формулы I, обладающие фунгицидной активностью. Согласно изобретению 1-пиридинил-2-азолил-1-(2-фенилэтенил)-этанолы-1 общей формулы I получают нагреванием 1-пиридинил-1-(2-оксиранил)-4-арилпропенов-2 с имидазолом или триазолом в присутствии твердого гидроксида щелочного металла в среде высококипящего полярного апротонного растворителя, например N-метилпирролидона, диметилформамида или диметилсульфоксида, при 100-150°С в присутствии воды или без нее где Py, Z, R1, R2 имеют те же значения, что и в формуле I. Замещенные 1-пиридинил-1-(2-оксиранил)-4-арилпропены-2 получают по реакции Кори-Чайковского из замещенных 1-пиридинил-3-арилпропен-2-онов-1 при взаимодействии их с солями триметилсульфония в диметилсульфоксиде или диметилсульфиде в присутствии сильного основания, например, трет-бутилата калия, трет-амилата натрия или гидрида натрия или в межфазных условиях при температуре от -10 до +5°С: где Рy и R1, R2 имеют те же значения, что и в формуле I, А- означает анион кислоты. В – означает основание. Для других субстратов такая реакция известна [E.J.Corey, M.Chaykovsky. Dimethyloxosulfonium methylide ((СН3)2SOСН2 and dimethylsulfonium methylide (CH3)2SCH2 Пример 1. К раствору 1,045 г (5 ммоль) 1-(3-пиридинил)-3-фенилпропен-2-она-1 и 1,43 г (7 ммоль) иодида триметилсульфония в 3,5 мл диметилсульфоксида прибавляют по каплям в течение 30 мин раствор 0,7 г (6,27 ммоль) трет-бутилата калия в 3 мл диметилсульфоксида в инертной атмосфере при охлаждении реакционной массы в бане со смесью льда и соли. Затем реакционную массу перемешивают в течение 15 мин и прибавляют по каплям 30 мл воды. Продукт экстрагируют четырьмя порциями по 50 мл диэтилового эфира, экстракт промывают насыщенным раствором хлорида натрия и сушат над сульфатом магния. Растворитель отгоняют и получают 0,95 г (85%). 1-(3-пиридинил)-1-(2-оксиранил)-3-фенилпропена-2. Спектр ЯМР 1Н (DMSO-d6, Пример 2. К раствору 0,245 г (3,5 ммоль) имидазола в 2 мл диметилформамида прибавляют 1 каплю воды, 0,04 г (1 ммоль) гидроксида натрия и 0,95 г (4,25 ммоль) 1-(3-пиридинил)-1-(2-оксиранил)-3-фенилпропена-2 и перемешивают в течение 4 ч при 120°С. Затем реакционную массу охлаждают, выливают в 25 мл воды и оставляют на несколько часов. Выпавшие кристаллы отфильтровывают и перекристаллизовывают из этанола. Получают 0,83 г (57%) 1-(3-пиридил)-2-(1-имидазолил)-1-(2-фенилэтенил)этанола-1. Выходы и температуры плавления 1-пиридинил-2-азолил-1-(2-фенилэтенил)этанолов-1 приведены в табл.1, данные ЯМР 1Н спектров – в табл.2. ЯМР 1Н спектры записаны на приборе Varian XL-400 (400 МГц). Пример 3. Испытания на биологическую активность соединений проводили в экспериментах in vitro. В расплавленный сахарозно-картофельный агар добавляли испытуемое вещество в виде композиции, содержащей 3 мг/мл действующего вещества, остальное – ацетон, по 1 мл на 100 мл агара. При этом получали агаровую среду, содержащую 30 мг/л испытуемого соединения. В среду для контроля добавляли чистый ацетон в том же количестве. Приготовленные таким способом среды разливали в чашки Петри, охлаждали и на поверхность затвердевшего агара высевали кусочки мицелия грибов, после чего чашки инкубировали в течение 3 суток при 25±0,5°С. Подавление роста мицелия вычисляли в процентах к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице 3.
Формула изобретения
1. Замещенные 1-пиридинил-2-азолил-1-(2-фенилэтенил)этанолы-1 общей формулы I где Ру означает 2-пиридинил, 3-пиридинил или 4-пиридинил, Z означает атом азота или группу СН, R1 и R2 независимо друг от друга означают атом водорода, галогена, трифторметильную группу. 2. Применение замещенных 1-пиридинил-2-азолил-1-(2-фенилэтенил)этанолов-1 по п.1 в качестве фунгицидов.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 28.03.2006
Извещение опубликовано: 20.02.2007 БИ: 05/2007
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

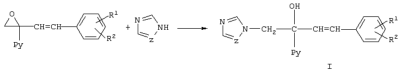
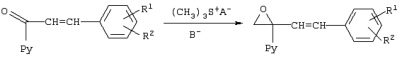
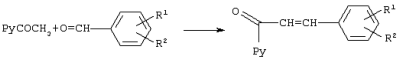
 , м.д., J, Гц): 3,19 и 3,28 (АВ-система, 2Н, СН2, J=9,3), 6,50 и 6,69 (АВ-система, 2Н, СН=СН, J=19,0), 7,25-7,52 (м, 6Н, 5 СН аром., 1 СН пирид.), 7,86, 8,58, 8,68 (все д, по 1Н, СН пирид.).
, м.д., J, Гц): 3,19 и 3,28 (АВ-система, 2Н, СН2, J=9,3), 6,50 и 6,69 (АВ-система, 2Н, СН=СН, J=19,0), 7,25-7,52 (м, 6Н, 5 СН аром., 1 СН пирид.), 7,86, 8,58, 8,68 (все д, по 1Н, СН пирид.).