Патент на изобретение №2243971
|
||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ХЛОРИДОВ 2,4-ДИАЛКИЛИНДОЛО[2,3-H]-1-ОКСААЗУЛЕНИЯ
(57) Реферат:
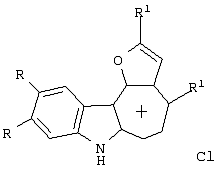
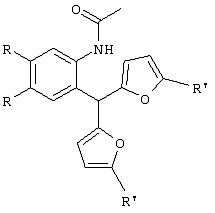
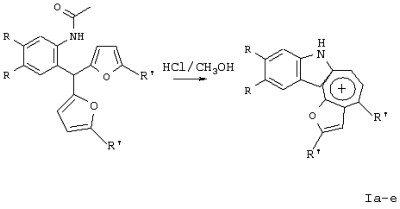
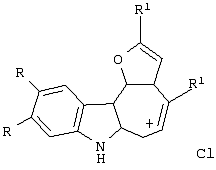
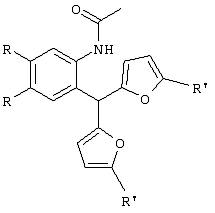
Изобретение относится к способу получения новых хлоридов 2,4-диалкилиндоло[2,3-h]-1-оксаазуления I общей формулы Iа R=ОСН3, R1-CH3; Iб R=H, R1=СН3; Iв R=-O-CH2-O-, R1=СН3; Iг R=-O-CH2-CH2-O-, R1=СН3; Iд R=ОСН3, R1=C2H5; Iе R=-O-CH2-O-, R1=C2H5 путем пропускания газообразного хлороводорода через раствор соответствующего производного 2-ацетиламиноарилбис(5-алкилфур-2-ил)метана формулы II: в метаноле при кипении в течение 80-90 минут. Способ обеспечивает получение новых тетрациклических производных, обладающих потенциальной противораковой активностью. 2 табл.
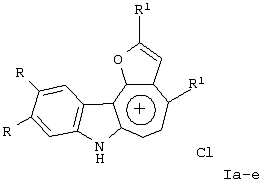
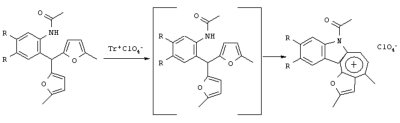
Изобретение относится к области органической химии – синтезу гетероциклических соединений – тетрациклических производных индола. Изобретение относится к разработке способа получения хлоридов 2,4-диалкилиндоло[2,3-h]-1-оксаазуления общей формулы I, которые могут найти применение как вещества, обладающие потенциальной противораковой активностью [Royer, H.; Joseph, D.; Prim, D.; Kirsch, G., Synth. Commun. 1998, 28: 7 1239-1252]. Ia R=ОСН3, R1=СН3; Iб R=H, R1=СН3; Iв R=-O-СН2-O-, R1=СН3; Iг R=-O-CH2-CH2-O-, R1=СН3; Iд R=ОСН3, R1=C2H5; Ie R=-O-СН2-O-, R1=С2Н5 Известен синтез тетрациклических производных индола, в котором для получения перхлоратов 2,4-диметилиндоло[2,3-h]-1-оксаазуления в качестве исходного соединения использованы производные бензилфурана – 2-ацетиламиноарилбис(5-метилфур-2-ил)метаны [Бутин А.В., Строганова Т.А., Абаев В.Т. и др., Химия гетероцикл. соедин. – 1997, 12, 1614]. По этому методу образование солей 2,4-диалкилиндоло[2,3-h]-1-оксаазуления происходит при взаимодействии соответствующих 2-ацетиламиноарил-бис(5-метилфур-2-ил)метанов с тритилперхлоратом в результате перегруппировки, образующихся на первой стадии 2-ацетиламиноарилдифурилкарбениевых ионов: Существенным недостатком этого способа является получение солей 2,4-диалкилиндоло[2,3-h]-1-оксаазуления в виде перхлоратов, что в значительной степени ограничивает их дальнейшее изучение и применение, поскольку большинство перхлоратов представляют собой довольно неустойчивые при нагревании и взрывоопасные вещества. Наиболее близким из известных способом получения конденсированных гетероциклических систем на основе замещенных бензилфуранов является синтез тетрациклических производных бензофурана из 2-гидроксибензилфуранов [Butin A.V., Gutnov A.V., Abaev V.Т., Krapivin G.D. Molecules 1999, 4, 52-61]. Тетрациклические производные бензофурана получены при нагревании 2-гидроксиарил-бис(5-метилфур-2-ил)метанов в диоксане в присутствии кислотного катализатора – концентрированной хлорной кислоты. Подобные условия не использовались ранее для получения тетрациклических производных индола. С целью введения в молекулу конденсированной гетероциклической системы хлорид-аниона нами предлагается использовать в качестве кислотного катализатора реакции газообразный хлороводород. Задача изобретения – разработка способа получения тетрациклических производных индола – хлоридов 2,4-диалкилиндоло[2,3-h]-1-оксаазуления I, позволяющего ввести в молекулу соли подходящий для дальнейших исследований анион – хлорид-анион; снижение осмоления реакционной массы и как следствие повышение выхода целевых продуктов. Поставленная задача достигается тем, что синтез хлоридов 2,4-диалкилиндоло[2,3-h]-1-оксаазуления I, включающий образование конденсированной тетрациклической системы в результате последовательного протекания реакций рециклизации фуранового кольца производных 2-ацетиламиноарил-бис(5-алкилфур-2-ил)метана и вторичной циклизации образующегося индольного кетона, проводят при пропускании газообразного хлороводорода через раствор производных 2-ацетиламиноарил-бис(5-алкилфур-2-ил)метана в метаноле при кипении в течение 80-90 минут. Отличием предлагаемого способа получения хлоридов 2,4-диалкилиндоло[2,3-h]-1-оксаазуления I является проведение реакции рециклизации в токе газообразного хлороводорода, а также использование в качестве органического растворителя метанола. Применение в качестве растворителя метанола объясняется лучшей растворимостью в нем исходных соединений. Использование постоянного тока газообразного НСl дает возможность поддерживать необходимую концентрацию хлороводорода, что снижает смолообразование в ходе реакции и позволяет, несмотря на некоторое увеличение длительности процесса за счет более низкой температуры (55°С – Ткип метанола), добиться повышения выхода целевых продуктов. Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата. Индивидуальность и строение синтезированных соединений I подтверждены данными ПМР-спектроскопии и элементного анализа. Примеры осуществления заявляемого способа получения хлоридов 2,4-диалкилиндоло[2,3-h]-1-оксаазуления I: Пример 1 Хлорид 9,10-диметокси-2,4-диметилиндоло[2,3-h]-1-оксаазуления (Iа) 3,13 г (0,01 моль) 2-(N-ацетиламино)-4,5-диметоксифенил-бис(5-метилфурил-2)метана растворяли при нагревании до кипения в 50 см3 метанола и при перемешивании через горячий раствор пропускали газообразный хлороводород до выпадения кристаллов (~30 мин.). Реакционную смесь выдерживали 10 ч при комнатной температуре, осадок отделяли фильтрацией, промывали небольшим количеством этанола, сушили, получая 0,87 г (32%) соединения Iа. Тразл.=203-205°С. Найдено для C19H18NClO3, %: С 66,42; Н 5,25; Сl 10,37; N 4,00; Вычислено: С 66,38; Н 5,28; С1 10,31; N 4,07. ПМР спектр (250 МГц, СF3СООD): 2,95 (с, 3Н); 3,18 (с, 3Н); 4,21 (с, 3Н); 4,26 (с, 3Н); 7,28 (с, 1Н); 7,49 (с, 1Н); 8,34 (д, J=11,0 Гц, 1Н); 8,49 (с, 1Н); 8,78 (д, J=11,0 Гц, 1Н) Пример 2. Хлорид 9,10-диметокси-2,4-диметилиндоло[2,3-h]-1-оксаазуления (Ia) получают аналогичным образом, используя 3,13 г (0,01 моль) 2-(N-ацетиламино)-4,5-диметоксифенил-бис(5-метилфурил-2)метана и 50 см3 метанола, дополнительно пропуская газообразный хлороводород после выпадения кристаллов еще в течение 30 мин. Выход продукта реакции в этом случае составляет 1,25 г (46%). Пример 3. Хлорид 9,10-диметокси-2,4-диметилиндоло[2,3-h]-1-оксаазуления (Ia) получают аналогичным образом, используя 3,13 г (0,01 моль) 2-(N-ацетиламино)-4,5-диметоксифенил-бис(5-метилфурил-2)метана и 50 см3 метанола и пропуская газообразный хлороводород в течение 50 мин после выпадения кристаллов. Выход соединения 1a-1,55 г (57%). Пример 4. Хлорид 9,10-диметокси-2,4-диметилиндоло[2,3-h]-1-оксаазуления (Ia) получают аналогичным образом, используя 3,13 г (0,01 моль) 2-(N-ацетиламино)-4,5-диметоксифенил-бис(5-метилфурил-2)метана и 50 см метанола и пропуская газообразный хлороводород в течение 60 мин после выпадения кристаллов. Выход соединения 1а-1,57 г (58%). Пример 5. Хлорид 9,10-диметокси-2,4-диметилиндоло[2,3-h]-1-оксаазуления (Iа) получают аналогичным образом, используя 3,13 г (0,01 моль) 2-(N-ацетиламино)-4,5-диметоксифенил-бис(5-метилфурил-2)метана и 50 см3 метанола и пропуская газообразный хлороводород в течение 80 мин после выпадения кристаллов. Выход соединения 1а-1,55 г (57%). В таблице 1 приведены данные о влиянии продолжительности пропускания газообразного хлороводорода на выход хлорида 9,10-диметокси-2,4-диметилиндоло[2,3-h]-1-оксаазуления (Iа) (примеры 1-5).
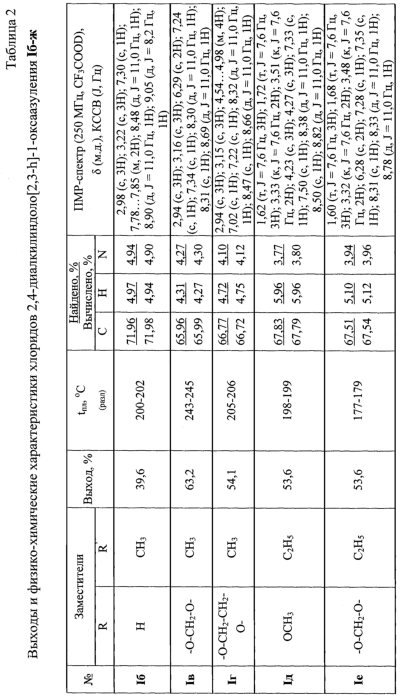
Как видно из таблицы, увеличение длительности обработки газообразным хлороводородом нецелесообразно, поскольку при этом наблюдается снижение выхода целевого продукта в результате частичного осмоления реакционной смеси. Таким образом, оптимальный выход хлорида 9,10-диметокси-2,4-диметилиндоло[2,3-h]-1-оксаазуления (Iа) достигается при проведении реакции в метаноле при дополнительной обработке реакционной смеси газообразным хлороводородом в течение 50-60 мин после выпадения кристаллов. Общая продолжительность реакции составляет 80-90 мин. Заявляемым способом получен ряд хлоридов 2,4-диалкилиндоло[2,3-h]-1-оксаазуления Iб-е, выходы, температуры плавления и спектральные характеристики которых приведены в таблице 2.
Формула изобретения
Способ получения хлоридов 2,4-диалкилиндоло[2,3-h]-1-оксаазуления I общей формулы Iа R=ОСН3, R1=CH3; Iб R=H, R1=CH3; Iв R=-O-СН2-O-, R1=СН3; Iг R=-O-CH2-CH2-O-, R1=СН3; Iд R=ОСН3, R1=C2H5; Iе R=-O-CH2-O-, R1=C2H5 заключающийся в образовании конденсированной тетрациклической системы в результате последовательного протекания реакций рециклизации фуранового кольца производных 2-ацетиламиноарил-бис(5-алкилфур-2-ил)метана и вторичной циклизации образующегося индольного кетона, включающий пропускание газообразного хлороводорода через раствор соответствующего производного 2-ацетиламиноарил-бис(5-алкилфур-2-ил)метана в метаноле при кипении в течение 80-90 мин.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 08.07.2005
Извещение опубликовано: 27.12.2006 БИ: 36/2006
|
||||||||||||||||||||||||||||||||||||||