Патент на изобретение №2242765
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОЙ АГГЛЮТИНИРУЮЩЕЙ СЫВОРОТКИ ПРОТИВ БРУЦЕЛЛ В L-ФОРМЕ
(57) Реферат:
Изобретение относится к области ветеринарии и медицины и может быть использовано для диагностики возбудителя бруцеллеза в L-форме. Сущность изобретения состоит в том, что сыворотку получают из крови кроликов после проведения двухцикловой гипериммунизации антигеном из субкультуры В.abortus И-206 в L-форме. Техническим результатом является получение высокоактивной и высокоспецифичной диагностической сыворотки против бруцелл в L-форме. 1 табл.
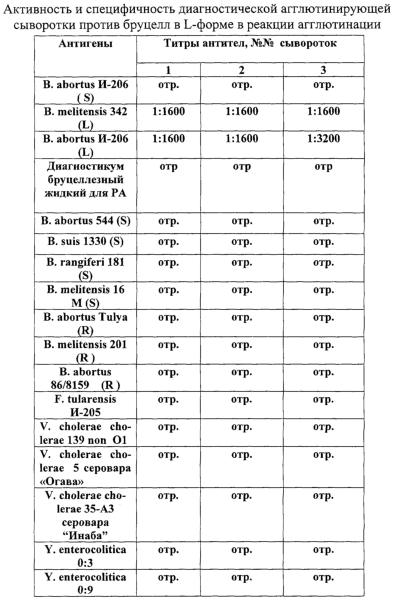
Изобретение относится к области медицины и ветеринарии, а именно к микробиологии и иммунологии, и может быть использовано для получения иммунной сыворотки, используемой для диагностики возбудителя бруцеллеза в L-форме. Известно, что от активности и специфичности иммунных сывороток зависит качество диагностических препаратов. Поливалентная бруцеллезная сыворотка не агглютинирует бруцеллы в стабильной L-форме и в связи с этим не может быть использована для их диагностики. Поэтому получение высокоспецифичной и высокоактивной диагностической агглютинирующей сыворотки против бруцелл в L-форме является актуальной задачей. Известен способ получения сывороток против бруцелл в L-форме при котором показано, что даже после заражения массивными дозами бруцелл в L-форме (105 м.к. – 3·109 Известно, что L-формы бруцелл обладают менее выраженными по сравнению с исходной бактериальной формой агглютинабельными свойствами, они взаимодействовали в реакции агглютинации (РА) собственной L-антисывороткой в разведении 1:640, в то время как исходная культура агглютинировалась с S-антисывороткой до титра 1:1280. Однако антисыворотка к L-формам агглютинировала и исходные бактериальные формы в разведении 1:320 [Базиков И.А. Получение и характеристика Л-форм бруцелл и их ревертантов. Автореф. дисс…. канд. мед. наук, Саратов, 1990, – с.16]. Вышеуказанные сообщения свидетельствуют о получении сывороток против бруцелл в L-форме, но с низкой активностью антител (AT) (титры AT в РА 1:10 и 1:640) и специфичностью, так как они реагируют с бруцеллами в S-форме в титрах AT (1:320), что ниже лишь на одно разведение, чем с бруцеллами в L-форме. Целью изобретения является получение высокоактивной и высокоспецифичной диагностической агглютинирующей сыворотки против бруцелл в L-форме. Поставленная цель достигается тем, что осуществляют двухцикловую гипериммунизацию кроликов АГ из субкультуры В.abortus И-206 в L-форме по оригинальной схеме, получают кровь, из которой готовят сыворотку. Сопоставительный анализ с прототипом показал, что предлагаемое техническое решение отличается от известного тем, что гипериммунизацию проводят по следующей схеме. Для получения диагностической сыворотки применяют двухцикловую схему гипериммуннизации инактивированным АГ, приготовленным из субкультуры В.abortus И-206 в L-форме. В первом цикле перед иммунизацией кроликам в подушечки задних лап вводят по 0,5-0,6 мл полного адъюванта Фрейнда (ПАФ), затем спустя 6-7 суток вводят АГ комбинировано в подколенные лимфатические узлы и внутримышечно (суспензия АГ с ПАФ). Спустя еще 3-4 суток инъекции повторяют, но уже в передние подушечки лап и внутримышечно. На 29-31 сутки от начала иммунизации, перед проведением второго цикла, готовят комплекс антиген-антитело (АГ-АТ). Через 30-32 суток проводят второй цикл, для чего кроликов иммунизируют комбинированно: комплекс АГ-АТ вводят внутривенно, а суспензию АГ с ПАФ – внутримышечно. Спустя 3-4 суток инъекции комплекса АГ-АТ и АГ повторяют. Через 7-9 суток после последней иммунизации животных кровопускают и получают диагностическую агглютинирующую сыворотку против бруцелл в L-форме. Таким образом, предлагаемое техническое решение соответствует критерию изобретения “новизна”. Проведенный анализ патентной и научно-технической литературы показал, что предлагаемый способ отличается не только от прототипа, но и от других технических решений в данной и смежных областях. Так, авторами не найден способ получения диагностической агглютинирующей сыворотки против бруцелл в L-форме, включающий предлагаемые режимы. А именно, предлагаемые режимы позволяют достичь поставленной цели – получить высокоактивную и высокоспецифичную диагностическую агглютинирующую сыворотку против бруцелл в L-форме. Данный способ не требует специального оборудования и реактивов и может быть использован при производстве этой сыворотки в лабораторных условиях. Предлагаемая диагностическая агглютинирующая сыворотка может быть использована в медицине и ветеринарии для диагностики измененных форм бруцелл, в частности L-форм. Таким образом, данный способ соответствует критериям “изобретательский уровень” и “промышленная применимость”. Способ осуществляется следующим образом: Берут инактивированную субкультуру В.abortus И-206 в L-форме и проводят гипериммунизацию кроликов по схеме, включающей два цикла. Первый цикл: кроликам в подушечки задних лап вводят по 0,5-0,6 мл ПАФ. Через 6-7 суток животных иммунизируют в подколенные лимфатические узлы задних лап по 0,3-0,5 мл суспензии АГ в забуференном физиологическом растворе рН 7,2-7,4 (ЗФР) в дозе 4·108-5·108 микробных клеток (м.к.) и внутримышечно – в дозе 4·108-5·108 м.к. в объеме 1,0 мл, содержащим 0,5 мл суспензии АГ и 0,5 мл ПАФ. Спустя 3-4 суток инъекции суспензии АГ проводят в подушечки передних лап в объеме 0,5-0,6 мл в дозе 109-2·109 м.к. и внутримышечно – 109-2·109 м.к. в объеме 1,0 мл (суспензия АГ-ПАФ по 0,5 мл). На 29-30 сутки от начала иммунизации готовят иммунный комплекс АГ-АТ, для чего от животных получают иммунную сыворотку, которую разливают в две пробирки по 1,0 мл. В каждую пробирку добавляют 1 мл суспензии АГ в соответствующей иммунизирующей дозе. Второй цикл иммунизации проводят через 30-32 суток. Комплекс АГ-АТ вводят внутривенно из расчета 2,5·109-3·109 м.к., а внутримышечно суспензию АГ из расчета 2·109-3·109 м.к. в объеме 0,25-0,5 мл с 0,5 мл ПАФ. Через 3-4 суток делают повторные внутривенные инъекции комплекса АГ-АТ 3·109-4·109 м.к. и внутримышечно суспензии АГ – 2·109-3·109 м.к. в 0,25-0,5 мл ЗФР с 0,5 мл ПАФ. Через 7-9 суток после последней иммунизации животным проводят кровопускание и получают сыворотку стандартным способом. Пример 1. Берут инактивированный антиген из субкультуры В.abortus И-206 в L-форме и проводят гипериммунизацию по следующей схеме. Первый цикл: кроликам в подушечки задних лап вводят по 0,6 мл ПАФ. Через 7 суток животных иммунизируют в подколенные лимфатические узлы задних лап по 0,5 мл суспензией АГ в дозе 5·108 м.к. и внутримышечно – в дозе 5·108 м.к. в объеме 1,0 мл, содержащем 0,5 мл суспензии АГ и 0,5 мл ПАФ. Спустя 4 суток инъекции АГ проводят в подушечки передних лап в дозе 2·109 м.к. в объеме 0,6 мл ЗФР и внутримышечно – 2·109 м.к. в объеме 1,0 мл (суспензия АГ-ПАФ по 0,5 мл). На 31 сутки от начала иммунизации готовят иммунный комплекс АГ-АТ, для чего от животных получают иммунную сыворотку, которую разливают в две пробирки по 1,0 мл. В первую пробирку добавляют 1,0 мл суспензии АГ в дозе 3·109 м.к., во вторую 1,0 мл суспензии АГ в дозе 4·109м.к. Второй цикл иммунизации проводят через 32 суток. Комплекс АГ-АТ вводят внутривенно из расчета 3·109 м.к., а внутримышечно вводят 0,5 мл суспензии АГ в дозе 3·109 м.к. с 0,5 мл ПАФ. Через 4 суток делают повторные внутривенные инъекции комплекса АГ-АТ, содержащего 4·109 м.к., а внутримышечно вводят 0,5 мл суспензии АГ (3·109 м.к.) с 0,5 мл ПАФ. Через 9 суток после последней иммунизации животных кровопускают и стандартным способом готовят диагностическую агглютинирующую сыворотку против бруцелл в L-форме. Полученная сыворотка имеет титр специфических AT 1:1600-1:3200. Пример 2. Берут инактивированный антиген из субкультуры В.abortus И-206 в L-форме и проводят гипериммунизацию по следующей схеме Первый цикл: кроликам в подушечки задних лап вводят по 0,5 мл ПАФ. Через 6 суток животных иммунизируют в подколенные лимфатические узлы задних лап по 0,3 мл суспензии АГ в дозе 4·108 микробных клеток (м.к.) и внутримышечно – в дозе 4·108 м.к. в объеме 1,0 мл, содержащем 0,5 мл суспензии антигена и 0,5 мл ПАФ. Спустя 3 суток, инъекции суспензии АГ проводят в подушечки передних лап в объеме 0,5 мл в дозе 109 м.к. и внутримышечно – 109 м.к. в объеме 1,0 мл (суспензия АГ-ПАФ по 0,5 мл). На 29 сутки от начала иммунизации готовят иммунный комплекс АГ-АТ, для чего от животных получают иммунную сыворотку, которую разливают в две пробирки по 1,0 мл. В первую пробирку добавляют 1,0 мл суспензии АГ в дозе 2,5·109 м.к., во вторую 1,0 мл суспензии АГ в дозе 3·109 м.к. Второй цикл иммунизации проводят через 30 суток. Комплекс АГ-АТ вводят внутривенно из расчета 2,5·109 м.к., а внутримышечно – суспензию АГ 2·109 м.к. 0,25 мл с 0,5 мл ПАФ. Через 3 суток делают повторные внутривенные инъекции комплекса АГ-АТ в дозе 3·109 м.к. и внутримышечные суспензии АГ в дозе 2·109 м.к. в объеме 0,25 мл с 0,5 мл ПАФ. Через 7 суток после последней иммунизации животных кровопускают и стандартным способом готовят диагностическую агглютинирующую сыворотку против бруцелл в L-форме. Полученная сыворотка имеет титр специфических AT 1:1600-1:3200. Полученная по данному способу диагностическая агглютинирующая сыворотка содержит антитела, которые обладают высокой специфичностью, так как взаимодействуют только с бруцеллами в L-форме и не взаимодействуют с бруцеллами в S- и R-формах, а также с другими микроорганизмами, имеющими с бруцеллами общие антигены (Francisella tularensis, Vibrio cholerae, Yersinia enterocolitica) и высокой активностью, о чем свидетельствует титр специфических AT, равный 1:1600-1:3200 (Таблица1). Кроме этого, использование сыворотки, полученной по предлагаемому способу, позволяет выявлять растворимые антигены бруцелл в L-форме в реакции иммунодиффузии в геле с формированием одной-двух полос преципитации и не образует таковые с антигенами бруцелл S-форме. Поливалентная бруцеллезная сыворотка в реакции иммунодиффузии в геле с антигенами бруцелл в S-форме формирует 2-3 и более полосы преципитации. Предлагаемый способ получения кроличьей гипериммунной сыворотки против бруцелл в L-форме более технологичен, так как включает иммунизацию животных инактивированным антигеном, что не требует организации специальных мер по защите работающего персонала. По сравнению с прототипом данный способ отличается прежде всего тем, что применяют двухцикловую гипериммунизацию по оригинальной схеме, что позволяет получить более специфичную и более активную сыворотку, у которой титры специфических AT против бруцелл в L-форме составляют в РА 1:1600-1:3200, в прототипе – 1:800-1:1600, но при этом, по сравнению с прототипом, где титры антител со стандартным бруцеллезным диагностикумом (S-форма) составили 1:400-1:800, в РА с предлагаемой L-сывороткой не зарегистрировано положительных реакций с бруцеллами в S- и R- формах, что свидетельствует об отсутствии необходимости адсорбции для удаления антител против S- и R-антигенов бруцелл. О высокой специфичности свидетельствует факт отсутствия взаимодействия диагностической сыворотки против бруцелл в L-форме с некоторыми микроорганизмами, имеющими с бруцеллами общие антигены.
Формула изобретения
Способ получения диагностической агглютинирующей сыворотки против бруцелл в L-форме, включающий иммунизацию животных антигеном из субкультуры В.abortus в L-форме, кровопускание животным и получение сыворотки, отличающийся тем, что гипериммунизацию проводят антигеном, полученным из субкультуры В.abortus И-206, двумя циклами следующим образом: в первом цикле кроликам в подушечки задних лап вводят по 0,5-0,6 мл полного адъюванта Фрейнда, через 6-7 суток вводят суспензию антигена комбинированно: в подколенные лимфатические узлы задних лап в дозе 4-10 – 5-10 м.к. и внутримышечно 4·108 – 5·108 м.к. с полным адъювантом Фрейнда, спустя 3-4 суток инъекции повторяют в дозе 109 – 2·109 м.к. в передние подушечки лап и внутримышечно с полным адъювантом Фрейнда, затем через 29-31 суток от начала иммунизации животным проводят кровопускание и получают иммунную сыворотку, к ней для получения комплекса антиген – антитело добавляют антиген в соотношении 1:1 в иммунизирующих дозах 2,5·109 – 3·109 м.к. и 3·109 – 4·109 м.к., через 30-32 суток проводят второй цикл иммунизации, который включает введение комплекса антиген – антитело внутривенно в дозе 2,5·109 – 3·109 м.к., а суспензии антигена с полным адъювантом Фрейнда – внутримышечно в дозе 2·109 – 3·109 м.к., спустя 3-4 суток инъекции комплекса антиген – антитело и суспензии антигена повторяют подобным же образом в дозах 3·109 – 4·109 м.к. и 2·109 – 3·109 м.к. соответственно, для получения сыворотки животных кровопускают через 7-9 суток.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 25.04.2005
Извещение опубликовано: 27.12.2006 БИ: 36/2006
|
||||||||||||||||||||||||||