Патент на изобретение №2241710
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ПИРИДО[1,2-А][1,3]БЕНЗИМИДАЗОЛОВ
(57) Реферат:
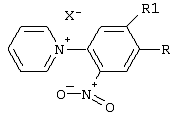
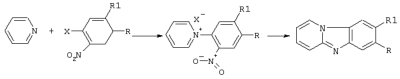
Описывается способ получения замещенных пиридо[1,2-а]-[1,3]бензимидазолов общей формулы где 1 R=NO2, Rl=H; 2 R=CF3, Rl=Н; 3 R=CN, Rl=H; 4 R=R1=CN, которые могут быть использованы в качестве полупродуктов в синтезе флуоресцентных и биологически активных веществ. Способ заключается во взаимодействии 2-нитро-4-R-5-Р1-галогенбензола с пиридином и восстановлении полученной соли N-(2-нитро-4-R-5-R1-фенил)пиридиния, причем взаимодействие 2-нитро-4-R-5-R1-галогенбензолов с пиридином осуществляют при температуре 20°С и мольном соотношении 2-нитро-4-R-5-Rl-галогенбензол:пиридин=l:7, а восстановлению подвергают спиртовой раствор соли раствором SnCl2·2H2O в 3%-ной НС1 при мольном соотношении соль N-(2-нитро-4-R-5-R1-фенил)-пиридиния: SnCl2·2H2O=1:3 при температуре 20°С в течение 0,12 ч. Описываемый способ позволяет получить целевой продукт с высоким выходом и чистотой из доступного сырья при комнатной температуре и в короткий промежуток времени. 2 табл.
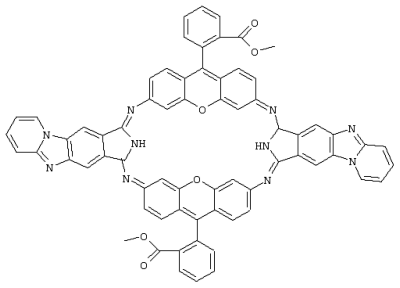
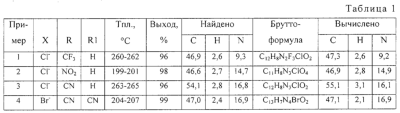
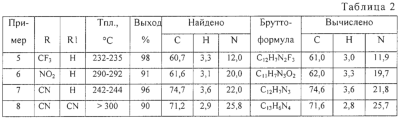
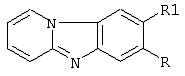
Изобретение относится к способу синтеза азотсодержащих гетероциклических соединений, в частности к получению замещенных пиридо[1,2- где 1 R=NO2, R1=Н; 2 R=СF3, R1=Н; 3 R=CN, R1=Н; 4 R=R1=CN. которые могут быть использованы в качестве полупродуктов в синтезе флуоресцентных и биологически активных веществ. К заявляемым соединениям относятся: 7-нитропиридо[1,2- 7-(трифторметил)пиридо[1,2- пиридо [1,2- пиридо[1,2- Известен способ получения замещенных пиридо[1,2- где R=H, NO2 Недостатками известного способа синтеза замещенных пиридо[1,2- Цель изобретения – снижение стоимости синтеза, сокращение времени и температуры проведения процесса, повышение чистоты и выходов целевых продуктов. Поставленная цель достигается тем, что в качестве исходного реагента вместо 2-аминопиридина используется более дешевый пиридин, взаимодействие пиридина с 2-нитро-4-R-5-К1-галогенбензолом проводят при температуре 20°С и мольном соотношении 2-нитро-4-R-5-R1-галогенбензол:пиридин =1:7, в течение 1 часа, восстановление спиртового раствора соли N-(2-нитро-4-R-5-R1-фенил)пиридиния проводят раствором SnCl2·2H2O в 3%-ной соляной кислоте и мольном соотношении соль N-(2-нитро-4-R-5-R1-фенил)пиридиния: SnСl2·2Н2О=1:3 при температуре 20°С в течение 0,12 ч, что позволяет снизить температуру реакции циклизации с 190°С до 2,0°С и уменьшить время процесса с 2,5 ч до 0,12 ч. где X=Cl, Br 1 R=NO2, R1=H; 2 R=СF3, Rl=H; 3 R=CN, Rl=H; 4 R=Rl=CN. Строение и чистоту промежуточных соединений и целевых пиридо[1,2- Изобретение иллюстрируется следующими примерами. Пример 1. N-(2-нитро-4-трифторметилфенил)пиридиний хлористый 5 г (0,022 моль) 2-нитро-4-трифторметилхлорбензола вносят в 11,7 мл (0,154 моль) пиридина и перемешивают при температуре 20°С в течение 1 часа. Выпавший осадок отфильтровывают и промывают 30 мл этилового croipia. Получают 6,43 г (96% от теории) М-(2-нитро-4-трифторметилфенил)пиридиния хлористого – белый порошок, Т. пл. 260-262°С. Найдено, %: С 46,9; Н 2,6; N 9,3 Вычислено, %: С 47,3; Н 2,6; N 9,2 1Н ПМР (DMSO-d6) Примеры 2-4. Соли N-(2-NO2-4-R-5-R1-фенил)пиридиния получают аналогично примеру 1. Физико-химические характеристики солей N-(2-NO2-4-R-5-R1-фенил)пиридиния приведены в таблице 1. Пример 5. 7-(Трифторметил)пиридо[1,2- К 5 г (0,016) соли N-(2-NO2-4-трифторметилфенил)пиридиния в 20 мл этилового спирта вносится при перемешивании 11,13 г (0,048 моль) SnCl2·2H2O в 20 мл 3%-ной соляной кислоты. Через 0,12 ч реакционная смесь подщелачивается 25%-ным водным раствором аммиака до рН=7-8 и экстрагируется несколькими порциями хлороформа ( Найдено, %: С 60,7; Н 3,3; N 12,0 Вычислено, %: С 61,0; Н 3,0; N 11,9 1Н ПMP (DMSO-d6) Примеры 6-7. Замещенные пиридо[1,2- Пример 8. Конденсация 4 с родамином 123. В колбу, снабженную мешалкой, термометром, обратным холодильником и капилляром для ввода аргона, загружают C12H7N3 2,2 г (0,01 моль) 4, 3,8 г (0,01 моль) родамина 123 и 10 г фенола. Полученную смесь медленно нагревают при перемешивании до 175…185°C. Образовавшийся расплав выдерживают при перемешивании в токе аргона до прекращения выделения аммиака. После окончания реакции реакционную смесь выливают в 20 мл этанола, выпавший осадок отфильтровывают, промывают 3 мл этанола и сушат при Т=60°C в течение 2 часов. Получают 10,3 г (94% от теории) гексазоциклана. Найдено, %: С 74,86; Н 3,81; N 12,65 Вычислено, %: С 74,58; Н 3,87; N 12,79: (С68Н42N10O6) В ИК-спектре гексазоциклана отсутствует полоса 2220 см-1 – C=N, присутствует полоса 680 см-1 – C=N-. Структурная формула гексазоциклана, полученного на основе 4 и родамина 123: Макрогетероцикл, полученный на основе 4 и родамина 123, имеет следующие спектральные характеристики: максимум спектра излучения – 578, 621, 709 нм при максимумах спектра поглощения – 301, 343, 430 нм.
Формула изобретения
Способ получения замещенных пиридо[1,2-а][1,3]бензимидазолов общей формулы I где 1. R – NO2, R1 – H; 2. R – CF3, R1 – H; 3. R – CN, R1 – H; 4. R = R1 – CN, заключающийся в том, что 2-нитро-4-R-5-R1-галогенбензол подвергают взаимодействию с пиридином при температуре 20°С и мольном соотношении 1:7 с последующим восстановлением с одновременной циклизацией образующейся соли N-(2-нитро-4-R-5-R1-фенил)пиридиния общей формулы II где Х – Сl, Вr; R и R1 имеют указанные выше значения, путем обработки спиртового раствора вышеназванной соли раствором SnCl2·2H2O в 3%-ной соляной кислоте и мольном соотношении соль N-(2-нитро-4-R-5-R1-фенил)пиридиния: SnСl2·2Н2O=1:3 при температуре 20°С в течение 0,12 ч.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 25.04.2008
Извещение опубликовано: 20.06.2010 БИ: 17/2010
|
||||||||||||||||||||||||||

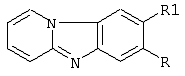
 ][1,3] бензимидазолов общей формулы
][1,3] бензимидазолов общей формулы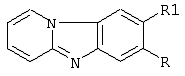
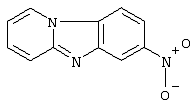
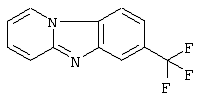
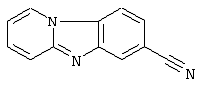
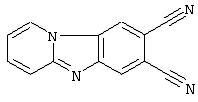
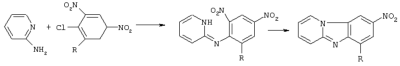
 , мд: 9,57 (d, 2Н, J=8,1), 8,98 (t, 1H, J=15,2), 8,67 (s,1H), 8,6 (d, 1H, J=8,0), 8,48 (d, 1H, J=8,2), 8,42 (t, 2H, J=13,3)
, мд: 9,57 (d, 2Н, J=8,1), 8,98 (t, 1H, J=15,2), 8,67 (s,1H), 8,6 (d, 1H, J=8,0), 8,48 (d, 1H, J=8,2), 8,42 (t, 2H, J=13,3) =200 мл). После отгонки хлороформа получают 3,7 г (98% от теории) 7-(трифторметил)пиридо[1,2-
=200 мл). После отгонки хлороформа получают 3,7 г (98% от теории) 7-(трифторметил)пиридо[1,2-